27.(2分)工人师傅配制溶质质量分数为9.8%的稀硫酸18.4kg,用于清洗钢铁表面的铁锈,需要溶质质量分数98%(密度为1.84g/cm3)浓硫酸的体积为________mL。
26.(4分)X是两种金属氧化物组成的混合物,为了研究混合物的成分,进行了如图所示的实验。
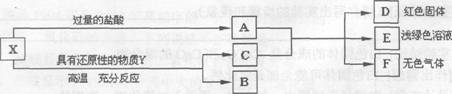
(1)x中含有的金属元素是 ______(填元素符号)。
(2)写出X中一种成分与盐酸反应的化学方程式:_________。
(3)若Y为固体,写出Y与X中一种成分反应的化学方程式 ______________;若Y为气体,Y还可以是__________(填化学式)。
25.(10分)水是宝贵的自然资源,在工农业生产和日常生活中有着极其广泛的应用。
(1)自来水的生产过程大体如下图:

上图过滤池中有活性炭层,活性炭起 作用,该过程中发生______变化。氯化时,通常通入一定量氯气,它与水反应生成盐酸和次氯酸。实验室配制AgN03溶液时不宜使用自来水,其原因是(用化学方程式表示)________。高铁酸钾(K2Fe04)是一种理想的水处理剂,高铁酸钾中铁元素的化合价是_________。(2)电解水时,加入少量NaOH可以增强水的导电性。现将0.1gNaOH溶解在99.9g水里,接通直流电源后,与电源正极相连的一端放出的气体是_________,当溶液中NaOH的质量分数变为0.2%时,有____________水被分解。
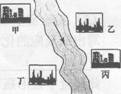
(3)在河旁有甲、乙、丙、丁四座工厂(位置如右图所示),每个工厂排出的废液只含有Na2C03、FeCl3、NaOH、HCl中的一种。某环保小组对河水监测时发现:甲处河水呈无色;乙处河水呈红褐色;丙处河水由浑变清;丁处产生气泡,河水澄清。请回答:
①甲工厂排出的废液是一种碱性物质,检验该物质呈碱性可选用的试剂是_________。
②乙处河水呈红褐色的化学方程式是________。
③丁处产生气泡的化学方程式是_______。
(4)保护水资源, 我们应该采取的措施是________。
24.(3分)我国化工专家侯德榜的“侯氏制碱法”为世界制碱工业做出了突出的贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。右表是几种物质在不同温度时的溶解度:
(1)从表中数据可以看出,温度对________的溶解度影响不大。
(2)要使NH4C1饱和溶液中的NH4C1结晶析出,在________(填“较高”或“较低”)温度下进行比较合适。
|
|
0℃ |
20℃ |
40℃ |
60℃ |
|
NaHC03 |
6.9 |
9.6 |
2.7 |
6.4 |
|
NaCl |
35.7 |
35.8 |
6.6 |
37.3 |
|
NH4Cl |
29.4 |
37.2 |
45.8 |
55.2 |
(3)“侯氏制碱法”制NaHC03的方程式是NaCI+C02+NH3+H20=NaHC03+NH4Cl,该反应能进行的原因是__________。
23。(6分)试依据核电荷数为1-18的元素的原子结构示意图,回答下列问题:
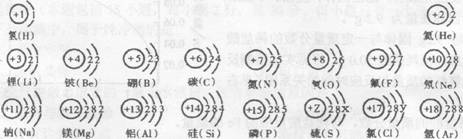
(1)上图中硫元素的核电荷数z=_______;氯元素的最外层电子数Y=______(填数值),则与氯元素化学性质相似的元素是______。
(2)核电荷数为12的元素的原子失去两个电子后,形成的粒子的符号是______,它的核外电子排布与_______元素的原子核外电子排布相同。
(3)上图的排列具有一定的规律,如:同一行中,从左到右元素的核电荷数依次增加。你还能找到哪些规律?试写出其中一个:________________________________________________________。
22.(3分)黄瓜中富含维生素C,其分子结构如右图。维生素c由____元素组成。维生素C在pH<5的环境中较稳定,为减少维生素C的损失,黄瓜在烹饪时应加入少量的______。维生素C片保存时,应注意避热、避光、密封,请你据此推测维生素c的化学性质_____________

21.(4分)请从H、C、O、K中选择合适的元素,按下列要求写出化学式(各写一例):
①酸性氧化物_______;②由三种元素组成的酸_________;
③可溶于水的碱_________;④由三种元素组成的盐__________。
20.密闭容器内有A、B、C、D四种物质,在一定条件下充分反应,测得反应前后各物质的质量
如下:
|
物 质 |
A |
B |
C |
D |
|
反应前质量/g |
19.7 |
8.7 |
31.6 |
O.4 |
|
反应后质量/g |
待测 |
17.4 |
0 |
3.6 |
下列说法正确的是
A.物质c一定是化合物,物质D可能是单质
B.反应后密闭容器中A的质量为19.7g
C.反应过程中,物质B与物质D变化的质量比为87:36
D.若物质A与物质C的相对分子质量之比为197"158,则反应中A与C的化学计量数之比为l:2
第1I卷(共60分)
19.下列括号中的物质是除去杂质所用的。其中正确的是
A.二氧化碳气体中有杂质一氧化碳(过量的氧气)
B.二氧化硫气体中有杂质氯化氢(过量的氢氧化钠溶液)
C.氯化钠溶液中有杂质硫酸钠(适量氯化钡溶液)
D.氢氧化钠溶液中有杂质碳酸钠(适量氯化钙溶液)
18.在金属活动性顺序表中,R元素排在氢前面,它的氧化物R203和氢氧化物R(OH)3都难溶于
水,而RCl3和R2(S04)3溶于水均有颜色。下列各组物质中能直接反应制得RCl3的是
A.R+HCl B.R203+HCI
C.R2(S04)3+BaCl2 D.R(OH)3+MgCl2

