nmolN2和Nmol14答案解析
科目:gzhx 来源: 题型:
| a | |||||
| b | |||||
| c | d | e |
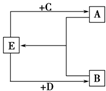 (2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:①A、B、E所含的该金属元素的原子结构示意图为
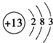
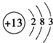
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为
科目:gzhx 来源: 题型:

CO2(g)+3H2(g)═CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ•mol-1)的变化:
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②该反应的平衡常数表达式K=
| c(CH3OH)•c(H2O) |
| c(CO2)•c3(H2) |
| c(CH3OH)•c(H2O) |
| c(CO2)•c3(H2) |
③下列措施中能使化学平衡向正反应方向移动的是
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
| 3 |
| 2 |
| 3 |
| 2 |
科目:gzhx 来源: 题型:
氯水:
氨水:
科目:gzhx 来源: 题型:
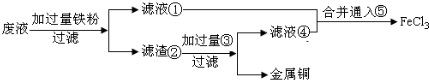
(1)请写出上述实验中加入或生成的有关物质的化学式:
①
(2)滤液①和滤液④合并后通入⑤的离子方程式是
科目:gzhx 来源: 题型:
请回答下列问题(题中的字母只代表元素代号,与实际元素符号无关):
(1)A~F六种元素原子,原子半径最大的是
(2)A、C、D三种元素组成的一种常见化合物,是重要的工业产品,该化合物电子式为:
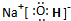
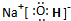
(3)B与F两种元素形成的一种化合物分子,各原子均达八电子结构,其中B显负价,F显正价,则该化合物水解的主要产物是:
(4)A、C、E三种元素形成的一种常见化合物,其浓溶液在加热条件下可与铜反应,该反应的化学方程式为
| ||
| ||
科目:gzhx 来源: 题型:阅读理解
A.“接触法”制H2SO4时,催化氧化阶段的反应原理为2SO2(g)+O2(g)
| 催化剂 |
| △ |
B.海水提镁的主要步骤为:

C.普通水泥的主要成分是硅酸钙
D.黏土的主要成分是三氧化二铝
Ⅱ.工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱.请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱.
①食盐和浓硫酸反应的化学方程式为
| ||
| ||
②硫酸钠和焦炭、石灰石反应的化学方程式为
| ||
| ||
(2)氨碱法的工艺如图1所示,得到的碳酸氢钠经煅烧生成纯碱.
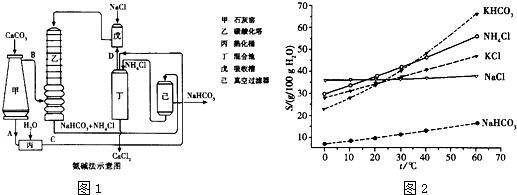
①图中的中间产物C是
②装置乙中发生反应的化学方程式为
(3)联合制碱法是对氨碱法的改进,其优点是
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
NH4Cl 可做氮肥;
可与合成氨厂联合,使合成氨的原料气 CO 转化成 CO2,革除了 CaCO3 制 CO2 这一工序
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾.请结合图1的溶解度(S)随温度变化曲线,分析说明是否可行?
科目:gzhx 来源: 题型:
 (2012•佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.
(2012•佛山二模)2012年2月27日深圳宣称进入“200万辆汽车时代”,汽车尾气已成为重要的空气污染物.(1)汽车内燃机工作时引起反应:N2(g)+O2(g)⇌2NO(g),是导致汽车尾气中含有NO的原因之一.T℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,该反应的速率υ(NO)为
(2)恒温恒容,能说明反应 2NO(g)⇌N2(g)+O2(g) 达到平衡的是
A.单位时间内消耗2mol NO,同时消耗1mol N2
B.NO、N2、O2的浓度之比为2:1:1
C.N2的浓度不再发生变化
D.容器内气体密度不再发生变化
(3)H2或CO可以催化还原NO以达到消除污染的目的:
①已知:N2(g)+O2(g)=2NO(g)△H=+180.5kJ/mol
2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为:
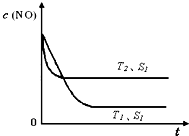
②当质量一定时,增大固体催化剂的表面积可提高化学反应速率.如图是反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g) 中NO的浓
度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H
科目:gzhx 来源: 题型:
①用离子方程式表示NaHA水溶液呈碱性的原因
②在NaHA水溶液中存在的微粒有
(2)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20.在25℃下,向浓度均为0.1mol•L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成
科目:gzhx 来源: 题型:
(2)在一定量的盐酸溶液中加入足量的锌粒,若使产生氢气的量保持不变,但反应速率加快,可加入
可选择的晶体有:
(A) 纯碱 (B)烧碱 (C)胆矾 (D) 醋酸钠 (E) KHSO4
(3)某研究小组拟用定量的方法测量Al和Fe分别与酸反应的快慢,设计了如图1所示的装置.
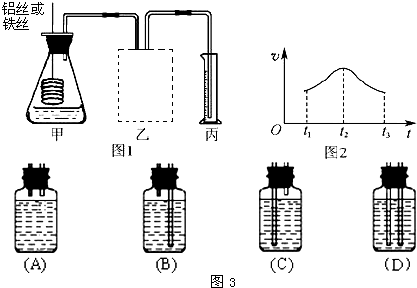
①在如图3所示的虚线框内连接合适的装置
②若要比较产生气体的快慢,可以测量相同时间段内产生气体的体积,也可以测量
③实验测得铝丝产生气体的速率(v)与时间(t)的关系如图2所示,则t1~t2时间段内反应速率逐渐加快的主要原因是
科目:gzhx 来源: 题型:
科目:gzhx 来源: 题型:阅读理解

请回答下列问题:
(1)操作1所用到的玻璃仪器的名称是
(2)由溶液3制取氢氧化铝的离子方程式为
(3)明矾石焙烧时产生SO2气体,请你写出能验证SO2气体具有还原性且实验现象明显的化学方程式
(4)请你写出验证溶液1中有NH4+的实验过程
(5)实验室用Fe2O3与CO反应来制取单质Fe.

①请你按气流由左到右方向连接下列各装置,顺序为:A→
②检验装置A气密性的方法是
③在点燃B处的酒精灯前,应进行的操作是
④装置C的作用是
科目:gzhx 来源: 题型:
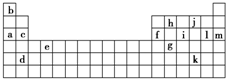 下表是周期表的一部分,表中所列的字母分别代表某一化学元素.
下表是周期表的一部分,表中所列的字母分别代表某一化学元素.(1)下列
①a、c、h ②b、g、k
③c、h、l ④d、e、f
(2)如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去.核外电子离开该原子或离子所需要的能量主要受两大因素的影响:原子核对核外电子的吸引力;形成稳定结构的倾向.
一些原子核失去核外不同电子所需的能量(kJ•mol-1)
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7 296 | 4 570 | 1 820 |
| 失去第三个电子 | 11 799 | 6 920 | 2 750 |
| 失去第四个电子 | 9 550 | 11 600 |
②表中X可能为以上13种元素中的
③Y是周期表中
④以上13种元素中,
科目:gzhx 来源: 题型:阅读理解
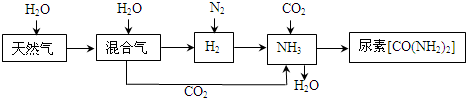
(1)天然气在高温、催化剂作用下与水蒸气反应生成H2和CO的化学方程式为
| ||
| ||
(2)在合成氨生产中,将生成的氨及时从反应后的气体中分离出来.运用化学平衡的知识分析这样做的是否有利于氨的合成,说明理由:
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数.
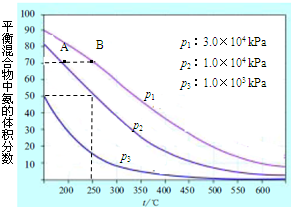
①若分别用υA(NH3)和υB(NH3) 表示从反应开始至达平衡状态A、B时的化学反应速率,则υA(NH3)
②在相同温度、当压强由p1变为p3时,合成氨反应的化学平衡常数
③在250℃、1.0×104kPa下,H2的转化率为
(4)NH3(g) 与CO2(g) 经过两步反应生成尿素,两步反应的能量变化示意图如下:
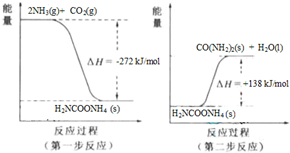
NH3(g) 与CO2(g) 反应生成尿素的热化学方程式为
(5)运输氨时,不能使用铜及其合金制造的管道阀门.因为,在潮湿的环境中,金属铜在有NH3存在时能被空气中的O2氧化,生成Cu(NH3)42+,该反应的离子方程式为
科目:gzhx 来源: 题型:阅读理解
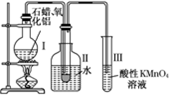 如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.
如何从石油中获得更多的轻质燃油一直是化学家探索的课题,将石油分馏得到的重油进行裂化可以获得更多的轻质燃油.资料1:石蜡是含有20~30个碳原子的烷烃的混合物,常温下呈固态.
资料2:石油催化裂化中通常使用Al2O3作催化剂.
某研究性学习小组在实验室中模拟石油的催化裂化,装置如图,实验过程中可观察到烧瓶Ⅰ中固体石蜡先熔化,试管Ⅱ中有少量液体凝结,试管Ⅲ中酸性高锰酸钾溶液退色,实验后闻试管Ⅱ中液体气味,具有汽油的气味.
(1)该装置仪器连接的顺序遵循原则为
(2)试管Ⅱ中少量液体凝结说明
(4)能否用试管Ⅱ中的液体萃取溴水中的溴,
(5)写出二十烷裂化得到癸烷和癸烯的化学方程式
| ||
| △ |
| ||
| △ |
(6)石油裂化的重要意义是
科目:gzhx 来源: 题型:
 (2010•长春一模)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
(2010•长春一模)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同( )
科目:gzhx 来源: 题型:

关于两容器中反应的说法正确的是( )
