【题目】根据有关知识回答下列问题。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式___________________________。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式_____________________________________。
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。

(3)A是石墨棒,B是一种金属,该金属是________(填名称)。
(4)B应接电源的________极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式___________________________________。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式_________________,当放出标况下112mL氢气时,该溶液的pH=_____________(室温下)。
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。

(7)若X为铜,为减缓铁的腐蚀,开关K应置于______处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为________________。
参考答案:
【答案】 Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-27kJ/mol O2+ 4H++ 4e-= 2H2O 铜 通入O2 2H++2e-=H2↑ 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 13 N 处 牺牲阳极的阴极保护法
2OH-+H2↑+Cl2↑ 13 N 处 牺牲阳极的阴极保护法
【解析】(1)已知:a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1,b、C(石墨)+CO2(g)=2CO(g)△H2=+172kJmol-1,依据盖斯定律a-b×3得到:Fe2O3(s)+3CO(g)═2Fe (s)+3CO2(g)△H=489-172×3=-27kJ/mol,故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-27kJ/mol;
(2)CO-O2燃料电池(以H2SO4溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳,原电池负极电极反应为:CO+H2O-2e-=CO2+2H+,正极电极反应为氧气得到电子发生还原反应,在酸性溶液中的电极反应为:O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
(3)要实现铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4,只能利用电解原理,A是石墨棒,B是一种金属,只能是铜,故答案为:铜;
(4)根据反应方程式,铜被氧化,因此B应接电源的正极,即通入O2的一极,故答案为:通入O2;
(5)该装置,溶液中的氢离子在阴极发生还原反应生成氢气,电极反应式为2H++2e-=H2↑,故答案为:2H++2e-=H2↑;
(6)用石墨作电极电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气、阴极上氢离子放电生成氢气,同时阴极附近有氢氧根离子生成,电池反应式为2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;设生成氢氧根离子的物质的量为x,
H2↑+Cl2↑+2OH-;设生成氢氧根离子的物质的量为x,
2Cl-+2H2O![]() H2↑+Cl2↑+2OH-;
H2↑+Cl2↑+2OH-;
22.4L 2mol
0.112L x
22.4L:2mol=0.112L:x,解得:x=![]() =0.01mol,c(OH-)=
=0.01mol,c(OH-)=![]() =0.1mol/L,则溶液的pH=13,故答案为:2Cl-+2H2O
=0.1mol/L,则溶液的pH=13,故答案为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,13;
2OH-+H2↑+Cl2↑,13;
(7)若X为铜,为减缓铁的腐蚀,铁比铜活泼,所以要采用外加电流的阴极保护法,所以为延缓铁腐蚀,K应置于N处,故答案为:N处;
(8)若X为锌,开关K置于M处,该方法为牺牲阳极的阴极保护法,故答案为:牺牲阳极的阴极保护法。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表中数据是常温下HClO和H2CO3的电离常数,回答有关问题。

(1)下列能正确表示水解的离子方程式的是______________。
A.HCO3- + H2O
 H2CO3+OH- B.HClO + H2O
H2CO3+OH- B.HClO + H2O ClO-+ H3O+
ClO-+ H3O+C.HCO3- + H2O
 CO32--+H3O+ D.CO32-+2H2O
CO32--+H3O+ D.CO32-+2H2O  H2CO3+2OH-
H2CO3+2OH-(2)浓度相同的①Na2CO3;②NaHCO3;③NaClO三种溶液的pH由小到大排列的顺序为(用编号填写)________________________。
(3)写出NaClO溶液中通入少量CO2气体的离子方程式________________________。
(4)在新制氯水中加入少量碳酸氢钠粉末后,氯水的漂白能力增强,请用有关化学知识解释原因_____________________________________________。
(5)在等浓度的NaClO、NaHCO3混合溶液中,阴离子浓度的大小关系是__________。
(6)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=____________________。
(7)已知HClO(aq)与NaOH(aq)反应的ΔH =-a kJ/mol;HCl(aq)溶液与NaOH(aq)反应的ΔH =-b kJ/mol。则HClO在水溶液中电离的ΔH等于____________。
(8)pH=12的NaClO溶液中,c(HClO)=___________mol/L。(精确表达)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
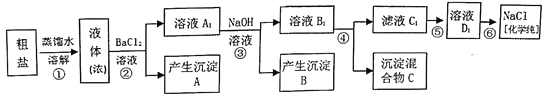
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________,②___________________________。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
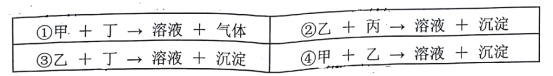
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】标准状况下一定体积的HCl气体,将其溶于500mL的稀硫酸溶液中,假设溶液的体积不变化,向混合溶液中加入0.60mol/L的NaOH溶液50mL恰好呈中性。继续向呈中性的溶液中加入过量的氯化钡溶液,所的沉淀的质量为2.33g。
(1)生成沉淀的离子反应方程式:_______________________________。
(2)原硫酸溶液的浓度为:______________________________________。
(3)标准状况下HCl气体的体积为多少毫升?(写出计算过程)__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B. 78g Na2O2与足量水充分反应时电子转移数为2NA
C. 标准状况下,22.4L SO3中所含的SO3分子数为NA
D. 常温常压下,8g O2所含的质子数为4NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g)
 CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol则:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
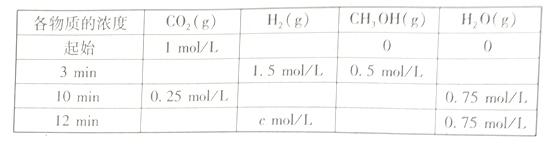
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
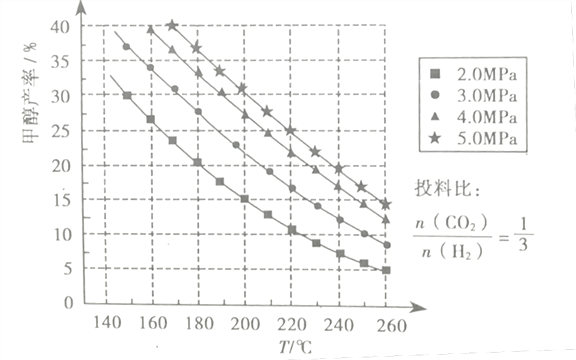
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq)
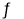 PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
相关试题

