【题目】工业上CO2用于生产燃料甲醇,既能缓解温室效应,也为能源寻找了新渠道。合成甲醇的反应为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。
(1)已知:CO的燃烧热△H=-283.0kJ/mol
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol
CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol
CH3OH(g) △H=-90.1KJ/mol
则:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=___KJ/mol
CH3OH(g)+H2O(g) △H=___KJ/mol
(2)T℃时,测得不同时刻恒容密闭容器中CO2(g)、H2(g)、CH3OH(g)、H2O(g)的浓度变化如下表所示
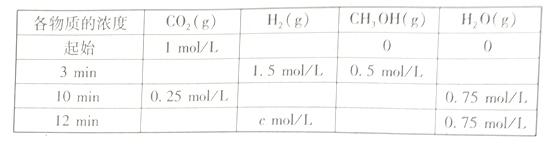
①c=___mol/L,从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=__
②下列能说明该反应达到平衡状态的是____________
A.每消耗 1mol CO2的同时生成1 mol CH3OH
B.容器中气体的压强不再改变
C.混合气体的平均相对分子质量不发生变化
D.容器中气体的密度不再改变
(3)在催化剂作用下,若测得甲醇的产率与反应温度、压强的关系如下图所示:
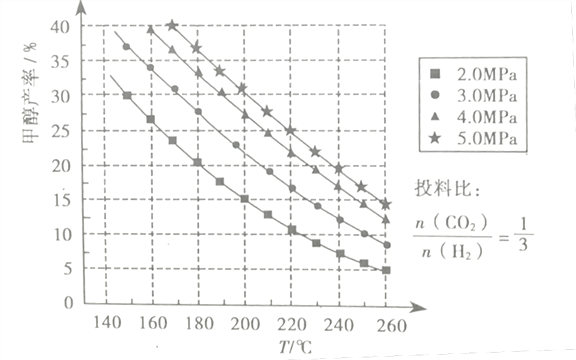
①分析图中数据可知,在220℃、5.0MPa时,CO2的转化率为__将温度降低至140℃、压强减小至2.0MPa,CO2的转化率将___(填“增大”、“减小”或“不变”)
②200℃、2.0MPa时,将amol/LCO2和3amol/LH2充入VL密闭容器中,在催化剂作用下反应达到平衡。根据图中数据计算所得甲醇的质量为___g(用含a的代数式表示)
(4)用NaOH溶液吸收CO2所得饱和碳酸钠溶液可以对废旧电池中的铅膏(主要成分PbSO4)进行脱硫反应。已知Ksp(PbSO4)=1.6x10-8,Ksp(PbCO3)=7.4×10-14,
PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
PbCO3(s)+SO42-(aq),则该反应的平衡常数K=______(保留三位有效数字);若在其溶液中加入少量Pb(NO3)2晶体,则c(SO42-):c(CO32-)的比值将______(填“增大”、“减小、”或“不变”)。
参考答案:
【答案】 -48.9 0.75 0.075 mol·(L·min)-1 BC 25% 增大 4.8aV 2.16×105 不变
【解析】(1)根据盖斯定律:①CO(g)+ 1/2O2(g)= CO2(g) △H=-283.0kJ/mol;②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ/mol; ③ CO(g)+2H2(g) ![]() CH3OH(g) △H=-90.1KJ/mol;三个反应联立,消去CO、O2,得总反应为CO2(g)+3H2(g)
CH3OH(g) △H=-90.1KJ/mol;三个反应联立,消去CO、O2,得总反应为CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-48.9KJ/mol;正确答案:-48.9。
CH3OH(g)+H2O(g) △H=-48.9KJ/mol;正确答案:-48.9。
(2)①根据图示可知,反应进行到3分钟时,甲醇的浓度为0.5 mol/L,消耗氢气1.5 mol/L,剩余氢气1.5 mol/L,原有氢气3 mol/L;反应进行到10分钟时,达到平衡状态,水蒸气变化了0.75 mol/L,氢气消耗了2.25 mol/L,剩余氢气3-2.25 =0.75 mol/L;达平衡时,甲醇的量为0.75 mol/L,CH3OH的平均反应速率v(CH3OH)=0.75/10=0.075 mol·(L·min)-1;正确答案:0.75; 0.075 mol·(L·min)-1 。
② 每消耗 1mol CO2的同时生成1 mol CH3OH,速率反应方向相同,A错误;该反应为体积变化V≠0反应,容器中气体的压强不再改变,反应达到平衡状态,B正确;反应前后混合气体的质量不变,反应后气体的总量变小,混合气体的平均相对分子质量不发生变化,反应达到平衡状态,C正确;反应前后混合气体的质量不变,容器的体积不变,容器中气体的密度恒为定值,不能判定反应是否达到平衡状态,D错误;正确选项BC。
(3)假设起始时CO2(g)为1 mol,转化率为x,根据反应方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知CH3OH的量为xmol,x/1×100%=25%, x=0.25mol,二氧化碳的转化率为0.25/1×100%=25%,温度越高,甲醇的产率越低,说明该反应为放热反应,压强越大,甲醇的产率越高,因此转化率将增大,正确答案:25% ; 增大。
② 起始时CO2(g)为aVmol,转化率为x,根据反应方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g),可知CH3OH的量为xmol,CH3OH的产率=x/aV×100%=15%, x=0.15 aVmol, CH3OH的质量为0.15 aV×32= 4.8aV;正确答案:4.8aV。
(4)PbSO4(s)+CO32-(aq) ![]() PbCO3(s)+SO42-(aq), 反应的平衡常数K= c(SO42-)/ c(CO32-)= Ksp(PbSO4)/ Ksp(PbCO3)= 1.6x10-8/7.4×10-14=2.16×105;若在其溶液中加入少量Pb(NO3)2晶体,对平衡没有影响,平衡不移动,所以c(SO42-):c(CO32-)的比值不变;正确答案:2.16×105;不变。
PbCO3(s)+SO42-(aq), 反应的平衡常数K= c(SO42-)/ c(CO32-)= Ksp(PbSO4)/ Ksp(PbCO3)= 1.6x10-8/7.4×10-14=2.16×105;若在其溶液中加入少量Pb(NO3)2晶体,对平衡没有影响,平衡不移动,所以c(SO42-):c(CO32-)的比值不变;正确答案:2.16×105;不变。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学反应中通常伴随着能量变化,下列说法中错误的是( )
A. 煤燃烧时将部分化学能转化为热能
B. 电解水制氢气时将部分化学能转化为电能
C. 炸药爆炸时将部分化学能转化为动能
D. 镁条燃烧时将部分化学能转化为光能
-
科目: 来源: 题型:
查看答案和解析>>【题目】下表是元素周期表的一部分,表中的每个字母表示一种短周期元素,回答下列问题:
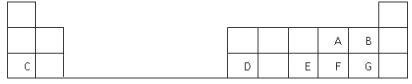
(1)画出C的原子结构示意图__________。
(2)D在元素周期表中的位置是第三周期第________族。
(3)A、B、E、F、G五种元素所形成的气态氢化物最不稳定的是__________(填化学式)。
(4)E、F元素的最高价氧化物对应水化物的酸性较强的是____________(填化学式)。
(5)写出C和F形成的化合物的电子式______________________。
(6)A、C、D的简单离子半径大小关系是__________________ (用离子符号表示)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度时,在2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
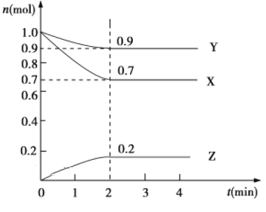
(1)起始时X的浓度为c(X)=________;反应从开始至2分钟末,Y的转化率为α(Y)=________;用Z的浓度变化表示0~2分钟内的平均反应速率为v(Z)=________。
(2)由图中所给数据进行分析,该反应的化学方程式为______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某物质在做焰色反应的实验中,通过蓝色的钴玻璃,发现焰色呈现紫色,该物质可能( )
A.NaCl
B.KCl
C.CuCl2
D.BaCl2 -
科目: 来源: 题型:
查看答案和解析>>【题目】用NaOH固体配制250 mL 1.00 mol/L NaOH溶液时,不必用到的仪器是
A.试管B.玻璃棒C.胶头滴管D.容量瓶
-
科目: 来源: 题型:
查看答案和解析>>【题目】NaClO2是一种漂白、消毒剂,广泛应用于纸浆、棉纺等物质漂白。一种制备NaClO2粗产品的工艺流程如下图所示:
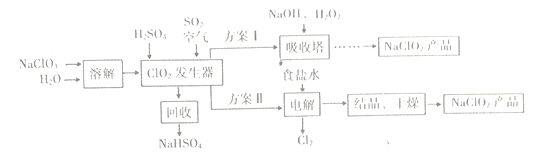
已知:①纯净的ClO2因易分解而发生爆炸。
②NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O晶体;高于38℃时析出
NaClO2晶体;高于60℃时NaClO2分解生成NaClO3和NaCl。
试回答下列问题:
(1)向发生器中鼓入足量空气,其目的是____(选填序号)。
a.将SO2氧化成SO3,以增强酸性
b.稀释CO2气体,以防止发生爆炸
c.将发生器中气体全部吹出,以减少ClO2损失
(2)吸收塔中反应的离子方程式为___
(3)ClO2发生器中反应的化学方程式为___________
(4)从吸收塔中可获得 NaClO2溶液,从NaClO2溶液到NaCO2产品,经过的操作步骤依次为:①______℃下减压蒸发结晶;②________;③洗涤;④低温干燥,得到成品。
(5)“电解”中阳极的电极反应式是_________,阴极反应的主要产物是_________。
相关试题

