【题目】下表中数据是常温下HClO和H2CO3的电离常数,回答有关问题。

(1)下列能正确表示水解的离子方程式的是______________。
A.HCO3- + H2O![]() H2CO3+OH- B.HClO + H2O
H2CO3+OH- B.HClO + H2O![]() ClO-+ H3O+
ClO-+ H3O+
C.HCO3- + H2O![]() CO32--+H3O+ D.CO32-+2H2O
CO32--+H3O+ D.CO32-+2H2O ![]() H2CO3+2OH-
H2CO3+2OH-
(2)浓度相同的①Na2CO3;②NaHCO3;③NaClO三种溶液的pH由小到大排列的顺序为(用编号填写)________________________。
(3)写出NaClO溶液中通入少量CO2气体的离子方程式________________________。
(4)在新制氯水中加入少量碳酸氢钠粉末后,氯水的漂白能力增强,请用有关化学知识解释原因_____________________________________________。
(5)在等浓度的NaClO、NaHCO3混合溶液中,阴离子浓度的大小关系是__________。
(6)在pH=8的NaClO和HClO混合液中,c(ClO-)/c(HClO)=____________________。
(7)已知HClO(aq)与NaOH(aq)反应的ΔH =-a kJ/mol;HCl(aq)溶液与NaOH(aq)反应的ΔH =-b kJ/mol。则HClO在水溶液中电离的ΔH等于____________。
(8)pH=12的NaClO溶液中,c(HClO)=___________mol/L。(精确表达)
参考答案:
【答案】 A ②<③<① ClO-+CO2+H2O=HClO+HCO3- 新制氯水中存在可逆反应Cl2+H2O![]() HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强 c(HCO3-)>c(ClO-)>c(OH-)>c(CO32-) 3 +(b-a)kJ/mol 10-2-10-12
HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强 c(HCO3-)>c(ClO-)>c(OH-)>c(CO32-) 3 +(b-a)kJ/mol 10-2-10-12
【解析】(1)A.HCO3- + H2O![]() H2CO3+OH-表示碳酸氢根离子的水解,正确;B.HClO + H2O
H2CO3+OH-表示碳酸氢根离子的水解,正确;B.HClO + H2O![]() ClO-+ H3O+是次氯酸的电离,错误;C.HCO3- + H2O
ClO-+ H3O+是次氯酸的电离,错误;C.HCO3- + H2O![]() CO32--+H3O+是碳酸氢根离子的电离,错误;D.CO32-水解分步进行,错误;故选A;
CO32--+H3O+是碳酸氢根离子的电离,错误;D.CO32-水解分步进行,错误;故选A;
(2)根据表格数据,酸性:碳酸>次氯酸>碳酸氢根离子,因此浓度相同的①Na2CO3;②NaHCO3;③NaClO三种溶液的水解程度①>③>②,水解程度越大,溶液的碱性越强,pH越大,pH由小到大排列的顺序为,故答案为:②<③<①;
(3)酸性:碳酸>次氯酸>碳酸氢根离子,则NaClO溶液中通入少量CO2气体反应生成次氯酸和碳酸氢钠,反应的离子方程式为ClO-+CO2+H2O=HClO+HCO3-,故答案为:ClO-+CO2+H2O=HClO+HCO3-;
(4)新制氯水中存在可逆反应Cl2+H2O![]() HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强,故答案为:新制氯水中存在可逆反应Cl2+H2O
HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强,故答案为:新制氯水中存在可逆反应Cl2+H2O![]() HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强;
HCl+HClO,加入NaHCO3后,NaHCO3与HCl反应使HCl浓度变小,平衡右移,NaHCO3不与HClO反应,所以HClO浓度增大,氯水漂白能力增强;
(5)在等浓度的NaClO、NaHCO3混合溶液中次氯酸根离子的水解程度大,则c(HCO3-)>c(ClO-),碳酸氢根离子的水解程度大于电离程度,溶液中的氢氧根离子由2种盐水解生成,因此碳酸根离子的浓度最小,阴离子浓度的大小关系为c(HCO3-)>c(ClO-)>c(OH-)>c(CO32-),故答案为:c(HCO3-)>c(ClO-)>c(OH-)>c(CO32-);
(6)在pH=8的NaClO和HClO混合液中,![]() =
=![]() =
=![]() =
=![]() =3,故答案为:3;
=3,故答案为:3;
(7)①HClO(aq)H+(aq)+ClO-(aq)△H1,②H+(aq)+OH-(aq)=H2O(l)△H2=-bkJmol-1,③OH-(aq)+HClO(aq)=CN-(aq)+H2O(l),△H3=-akJmol-1,根据盖斯定律:①+②=③,△H1+△H2=△H3,△H1=+(b-a)kJmol-1,故答案为:+(b-a)kJmol-1;
(8)pH=12的NaClO溶液中存在物料守恒c(Na+)= c(ClO-)+c(HClO),电荷守恒c(Na+)+ c(H+)= c(ClO-)+ c(OH-),则c(HClO)= c(H+)- c(OH-)=10-2-10-12 mol/L,故答案为:10-2-10-12。
-
科目: 来源: 题型:
查看答案和解析>>【题目】物质的量浓度相等的NaCl、FeCl2、FeCl3三种溶液分别与等物质的量浓度的AgNO3溶液恰好完全反应,则NaCl、FeCl2 、FeCl3三种溶液的体积之比是
A. 1:2:3 B. 3:2:1 C. 6::3:2 D. 1:1:1
-
科目: 来源: 题型:
查看答案和解析>>【题目】(1)下列物质:①氯气,②澄清石灰水,③水银,④稀盐酸,⑤氯化铜固体,⑥熔融氢氧化钠,⑦蔗糖,⑧酒精,⑨二氧化碳,⑩硫酸钡。其中属于电解质的是______(填序号,下面相同),属于非电解质的是_________,能导电的是_________。
(2)写出高锰酸钾受热分解制氧气的化学反应方程式____________________,反应中的氧化剂是________,还原产物是____________,当有2mol电子转移时,生成的氧气在标准状况下的体积是________L。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学生欲配制3.0mol/L的H2SO4溶液100mL,实验室有标准浓度为90%、密度为1.80g/mL的硫酸溶液。请回答下列问题:
(1)实验所用90%的硫酸的物质的量浓度为________mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为_______mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤A、C补充完整。
A.用量简准确量取所需的90%的硫酸溶液_______mL,沿玻璃棒倒入少量蒸馏水中,并用玻璃棒搅拌,使其混合均匀;
B.将混合均匀的硫酸溶液沿玻璃棒注入所选的容量瓶中;
C.______________________________________________;
D.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
E.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
F.将容量瓶盖紧,振荡,据匀。
(4)如果省略操作C,对所配溶液浓度有何影响?______(填“偏大”、“偏小”或无影响”)
(5)进行操作B前还需注意__________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究性学习小组同学用含有少量泥沙、CaCl2、MgCl2、Na2SO4的粗盐制取纯净的NaCl,实验前他们设计了如图方案(框图)
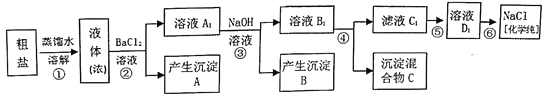
(1)请写出操作第④步所加试剂名称及第②步操作名称:
④_____________________,②___________________________。
(2)写出第⑤步操作中可能发生反应的离子方程式:____________________。
(3)如何检验第②步操作中硫酸根离子已完全除尽:_____________________。
(4)你认为该设计里哪些步骤调换后不影响实验结果:___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有失去标签的甲、乙、丙、丁四瓶溶液,它们分別是Ba(NO3)2、H2SO4、Na2SO4、K2CO3的一种,为了鉴别他们,进行了如下实验:
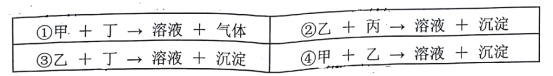
在④得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
(1)从④得到沉淀所使用的玻璃仪器有__________________________。
(2)乙、丁的名称分别是:乙_______________,丁_____________。
(3)请写出在④得到的沉淀中加入足量稀盐酸的离子反应方程式__________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据有关知识回答下列问题。
(Ⅰ)研究CO2的利用具有现实意义,比如将CO2与焦炭作用生成CO,CO可用于炼铁、设计燃料电池等。
(1)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH 1 =+489 kJ/mol
C(石墨)+CO2(g)=2CO(g) ΔH 2 = +172 kJ/mol
写出Fe2O3和CO为原料冶炼铁的热化学方程式___________________________。
(2)利用CO燃烧反应可设计成CO/O2燃料电池(以H2SO4溶液为电解质溶液),写出该电池的正极反应式_____________________________________。
(Ⅱ)初中我们学过铜不能与稀硫酸反应。某学生利用上述CO/O2燃料电池设计了如图所示装置(框内部分未画出),实现了铜与稀硫酸的反应:Cu+H2SO4=H2↑+CuSO4(未注明反应条件)。回答下列问题。

(3)A是石墨棒,B是一种金属,该金属是________(填名称)。
(4)B应接电源的________极(填“通入CO”或“通入O2”)。
(5)写出该装置中发生还原反应的电极反应式___________________________________。
(6)若C溶液为100mL饱和食盐水,A和B电极均为石墨棒,该学生连通电路,写出烧杯中反应的离子方程式_________________,当放出标况下112mL氢气时,该溶液的pH=_____________(室温下)。
(Ⅲ)将(Ⅱ)中装置改造成下图装置,可以模拟铁的电化学防护。

(7)若X为铜,为减缓铁的腐蚀,开关K应置于______处。
(8)若X为锌棒,开关K置于M处,该电化学防护法称为________________。
相关试题

