【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
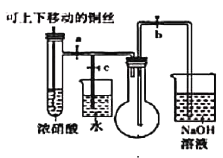
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃ | A | B | C | D |
沸水浴 | 红棕色 | 红棕色 | 红棕色 | 红棕色 |
80-70 | 红棕色 | 红棕色 | 红棕色 | 无色 |
50-40 | 红棕色 | 仅液面上红棕色 | 无色 | 无色 |
20-10 | 仅液面上红棕色 | 无色 | 无色 | td style="width:88.95pt; border-top-style:solid; border-top-width:0.75pt; border-left-style:solid; border-left-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。
参考答案:
【答案】烧瓶中的导管短进长出 c a和b 将铜丝提起与溶液脱离 0.04 C 5HNO2+2MnO4-+H+==5NO3-+2Mn2++3H2O 胶头滴管 HNO2不稳定,易分解 浓度大,温度高时
【解析】
(1) ①二氧化氮的密度大于空气,装置中烧瓶中的导管短进长出,无法收集到气体;
②若要让NO2充满烧瓶,需要关闭弹簧夹c、打开弹簧夹a和b;
③当气体充满烧瓶后,将铜丝提起与溶液脱离,即可使反应停止;
(2) ①根据化学方程式3NO2+H2O=2HNO3+NO,设二氧化氮的体积为VL,则物质的量为![]() ,生成的HNO3为0.04Vmol×
,生成的HNO3为0.04Vmol×![]() ,所得溶液的体积为
,所得溶液的体积为![]() VL,故烧瓶中溶液的浓度是
VL,故烧瓶中溶液的浓度是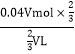 =0.04mol/L;
=0.04mol/L;
②A.NO不溶于水,不能使烧瓶中液面上升到几乎充满整个烧瓶,选项A错误;
B.N2O4与二氧化氮一样均能与水反应生成不溶于水的一氧化氮,不能使烧瓶中液面上升到几乎充满整个烧瓶,选项B错误;
C.二氧化氮与水反应生成的一氧化氮又与O2反应生成二氧化氮,二氧化氮与水反应生成NO,最后可完全转化为硝酸,能使烧瓶中液面上升到几乎充满整个烧瓶,选项C正确;
D.空气中的氮气不溶于水,不能使烧瓶中液面上升到几乎充满整个烧瓶,选项D错误;
答案选C;
③高锰酸钾溶液酸性条件下被亚硝酸还原而褪色,根据氧化还原反应原理可得反应的离子方程式为5HNO2+2MnO4-+H+=5NO3-+2Mn2++3H2O;
(3)①第一步实验为配制1mol/LNaNO2溶液100mL,要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和胶头滴管;
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是HNO2不稳定,易分解;
③通过实验现象得出结论:浓度大,温度高时,亚硝酸按反应Ⅰ发生分解生成红棕色的NO2。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某反应在体积为5L的恒容密闭容器中进行,在0~3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色)。
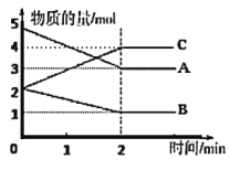
(1)该反应的化学方程式为______________________________;
(2)反应开始至2分钟时,A的平均反应速率为______________;
(3)下列措施能使该反应加快的是____________(仅改变一个条件)
a.降低温度 b.缩小容积 c.恒容时充入Ar气,增大压强
(4)能说明该反应已达到平衡状态的是__________(填序号)。
①单位时间内生成nmolB的同时生成2nmolC
②单位时间内生成nmolB的同时生成2nmolA
③容器内压强不再随时间而发生变化的状态
④A、B、C的物质的量浓度之比保持3:1:4不变的状态
⑤混合气体的颜色不再改变的状态
⑥混合气体的密度不再改变的状态
⑦υ逆(B)=2υ正(C)
-
科目: 来源: 题型:
查看答案和解析>>【题目】“结晶玫瑰”具有强烈的玫瑰香气,是一种很好的定香剂,其化学名称为“乙酸三氯甲基苯甲酯”,通常以三氯甲基苯基甲醇和醋酸酐为原料制备:
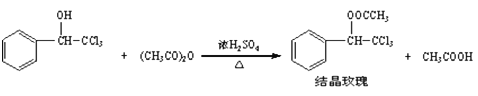
已知:

操作步骤如下:
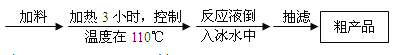
请根据以上信息,回答下列问题:
(1)加料时,应先加入三氯甲基苯基甲醇和酷酸酐,然后慢慢加入浓硫酸并______,待混合均匀后,最适宜的加热方式为______(填“水浴加热”或“油浴加热”)。
(2)粗产品的成分是结晶攻瑰与少量_______(填名称)的混合物,设计了如下方案进行提纯和检验。请完成表中内容:
序号
实验方案
实验现象
结论
①
将粗产品溶解在中,按粗产品、溶剂的质量比为1:__混合,用水浴加热到70℃回流溶剂使粗产品充分溶解
得到无色溶液
②
将步骤1所得溶液____________抽滤
得到白色晶体
③
干燥步骤2所得白色晶体,____________
_____________
白色晶体是结晶玫瑰
(3)4.51g三氯甲基苯基甲醇与足量乙酸酐充分反应得到结晶玫瑰4.68g,则产率是________(小数点后保留两位有效数字)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】扁桃酸衍生物Z是重要的医药中间体,其合成路线如下:

下列叙述正确的是
A. 化合物X、Y、Z和H2发生加成反应后的产物均含2个手性碳原子
B. 两分子X可生成一个含有3个六元环的分子
C. 化合物Z可发生氧化反应、取代反应、加聚反应和缩聚反应
D. 化合物X与NaHCO3和Na2CO3溶液都能反应,且都可以产生CO2气体
-
科目: 来源: 题型:
查看答案和解析>>【题目】电解质在生产生活中有着十分重要的作用。下列物质中属于电解质的是
A.二氧化氮B.金属铜C.氯化钠D.盐酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知反应2HI(g) == H2(g) + I2(g)的ΔH= +11 kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为
A.576 kJB.283 kJC.598 kJ·D.299 kJ
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层的电子数之和。
(1)C2D电子式为__________,D原子的质子数和中子数相等,D的原子组成符号为______。
(2)用电子式表示A、B两元素形成AB2的过程_______________________________。
(3)E和A的最高价氧化物反应的化学方程式_________________________________。
(4)足量的AB2与C的最高价氧化物对应水化物反应的化学方程式为________________。
相关试题

