【题目】已知反应2HI(g) == H2(g) + I2(g)的ΔH= +11 kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为
A.576 kJB.283 kJC.598 kJ·D.299 kJ
参考答案:
【答案】D
【解析】
设1molHI(g)分子中化学键断裂时需吸收的能量为xkJ,化学键断裂时需吸收的能量化学键生成时需放出的能量=反应吸收的热量,即:2xkJ436kJ151kJ=11kJ,解得:x=299,
故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】扁桃酸衍生物Z是重要的医药中间体,其合成路线如下:

下列叙述正确的是
A. 化合物X、Y、Z和H2发生加成反应后的产物均含2个手性碳原子
B. 两分子X可生成一个含有3个六元环的分子
C. 化合物Z可发生氧化反应、取代反应、加聚反应和缩聚反应
D. 化合物X与NaHCO3和Na2CO3溶液都能反应,且都可以产生CO2气体
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验小组收集“铜与浓硝酸反应”生成的气体进行探究。试回答下列问题
(1)下图是“铜与浓硝酸反应”的实验装置
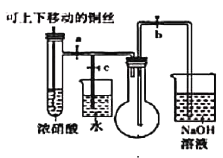
①指出装置中的错误_________________________。
②装置改进后,为了使生成的气体充满烧瓶,实验时先关闭弹簧夹_______,再打开弹簧夹________。
③当气体充满烧瓶后,___________________________,即可使反应停止。
(2)当烧瓶中充满红棕色的气体时停止实验,取下烧瓶,塞好橡皮塞。
①把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,烧瓶中水面上升,根据化学方程式3NO2+H2O=2HNO3+NO计算烧瓶中溶液的浓度是______mol/L(假设溶质未扩散到水槽,且当时条件下气体的摩尔体积为25L/mol)
②把烧瓶倒扣在装水的水槽中并打开烧瓶的橡皮塞,实验时发现烧瓶中液面上升几乎充满了整个烧瓶,产生这种现象的原因可能是收集的NO2中含有__________。
A.NO B.N2O4 C.O2 D.空气
③小组同学查阅资料发现,NO2溶于水时能生成硝酸和亚硝酸:2NO2+H2O=HNO3+HNO2,为了证明这是造成剩余气体少的主要原因,小组同学把烧瓶中的溶液滴加高锰酸钾溶液,发现高锰酸钾溶液褪色,写出高锰酸钾溶液褪色的离子方程式____________________________。
(3)HNO2是一种不稳定易分解的弱酸:Ⅰ.2HNO2=NO↑+NO2↑+H2O,Ⅱ.3HNO2=HNO3+2NO↑+H2O。为了探究不同温度、浓度下亚硝酸的分解产物,小组同学进行如下实验:
第一步:配制1mol/LNaNO2溶液100mL(标为溶液A)。
第二步:取溶液A分别加水稀释为0.5mol/L、0.2mol/L、0.1mol/L的溶液,依次标为溶液B、C、D。
第三步:分别取两滴管溶液A~D溶液于试管中,塞上橡皮塞后置于不同温度的水中加热5min,再加入一滴管10mol/LH2SO4溶液并立即塞紧橡皮塞,观察生成气体的颜色
水浴温度/℃
A
B
C
D
沸水浴
红棕色
红棕色
红棕色
红棕色
80-70
红棕色
红棕色
红棕色
无色
50-40
红棕色
仅液面上红棕色
无色
无色
20-10
仅液面上红棕色
无色
无色
无色
①第一步实验要用到玻璃仪器有:烧杯、100mL容量瓶、玻璃棒和___________。
②用NaNO2溶液加硫酸而不直接用HNO2溶液的原因是______________。
③通过实验现象得出结论:____________条件下,亚硝酸按反应Ⅰ发生分解。
-
科目: 来源: 题型:
查看答案和解析>>【题目】电解质在生产生活中有着十分重要的作用。下列物质中属于电解质的是
A.二氧化氮B.金属铜C.氯化钠D.盐酸
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C、D四种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层的电子数之和。
(1)C2D电子式为__________,D原子的质子数和中子数相等,D的原子组成符号为______。
(2)用电子式表示A、B两元素形成AB2的过程_______________________________。
(3)E和A的最高价氧化物反应的化学方程式_________________________________。
(4)足量的AB2与C的最高价氧化物对应水化物反应的化学方程式为________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于电子式的相关描述中正确的是( )
A. CCl4的电子式为
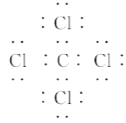
B. CaCl2的电子式

C. 由氨气的电子式
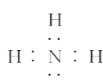 可知,每个氨气分子含有8个电子
可知,每个氨气分子含有8个电子D. 用电子式表示氯化氢的形成过程
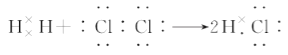
-
科目: 来源: 题型:
查看答案和解析>>【题目】在密闭容器中发生反应X(g)+3Y(g)
 2Z(g),若X、Y、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1和0.2mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )
2Z(g),若X、Y、Z的起始浓度分别为0.1mol·L-1、0.3mol·L-1和0.2mol·L-1,在一定条件下,当反应达到一定限度时,各物质的浓度可能是( )A. X为0.2 mol·L-1B. Y为0.1 mol·L-1
C. Z为0.4 mol·L-1D. Z为0.1 mol·L-1时,Y为0.4 mol·L-1
相关试题

