【题目】关于下列粒子的描述不正确的是( )
A. PH3的电子式为![]() ,其热稳定性不如NH3
,其热稳定性不如NH3
B. HS-的电子式为![]() ,是含有极性键的18电子的粒子
,是含有极性键的18电子的粒子
C. CH2Cl2的电子式为![]() ,是结构呈正四面体的分子
,是结构呈正四面体的分子
D. KF的电子式为![]() ,它是易溶于水的离子化合物
,它是易溶于水的离子化合物
参考答案:
【答案】C
【解析】试题分析:A.PH3为共价化合物,其电子式为![]() ;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;B.HS-中硫原子核外达到8电子稳定结构,其电子式为
;由于非金属性N>P,所以磷化氢的热稳定性不如NH3,故A正确;B.HS-中硫原子核外达到8电子稳定结构,其电子式为![]() ,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;C.CH2Cl2为共价化合物,其电子式为
,离子中硫氢键为极性共价键,硫氢根离子为18电子的粒子,故B正确;C.CH2Cl2为共价化合物,其电子式为![]() ,是分子结构呈四面体的分子,故C错误;D.氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:K+
,是分子结构呈四面体的分子,故C错误;D.氟化钾为离子化合物,电子式中需要标出离子所带的电荷,其电子式为:K+![]() ,氟化钾易溶于水,故D正确;故选C。
,氟化钾易溶于水,故D正确;故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】具有漂白作用的物质有:①84 消毒液 ②二氧化硫 ③过氧化氢 ④漂白粉,其漂白原理相同的是
A.①③B.②③C.①③④D.①②④
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 标准状况下,5.6L.Cl2与足量NaOH反应转移的电子数为0.25NA
B. 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3
 2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移的电子数目为3.75NA -
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A. 反应MgO(s)+C(s)=Mg(s)+CO(g)在室温下不能自发进行,则该反应的△H>0
B. 原电池输出电能的能力取决于组成原电池的反应物的氧化还原能力
C. 0.1 mol·L-1CH3COOH溶液加水稀释后,溶液中
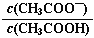 的值减小
的值减小D. 锅炉中沉积的CaSO4可用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各表述与示意图一致的是( )
A.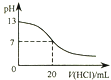
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.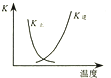
图中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化
C.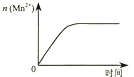
图③表示10 mL 0.01 molL﹣1 KMnO4 酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.
图中a、b曲线分别表示反应CH2=CH2 (g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 -
科目: 来源: 题型:
查看答案和解析>>【题目】将面团包在纱布中在清水中搓洗,鉴定黏留在纱布上的黏稠物质和洗出的白浆用的试剂分别是 ( )
A.碘液、苏丹Ⅲ染液 B.双缩脲试剂、碘液
C.斐林试剂、碘液 D.碘液、斐林试剂
-
科目: 来源: 题型:
查看答案和解析>>【题目】将20 mL 0.5 mol/L Al2(SO4)3溶液加水稀释到500 mL,稀释后溶液中SO42﹣浓度为( )
A.0.01 mol/L
B.0.02 mol/L
C.0.03mol/L
D.0.06mol/L
相关试题

