【题目】现有短周期元素R、X、Y、Z、T,R与T原子最外层电子数均是电子层数的2倍,Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:R<X<Y
C. T的最高价氧化物的水化物酸性比R的强
D. Y和Z分别与T、X组成的二元化合物的水溶液一定呈中性
参考答案:
【答案】C
【解析】原子序数R<X<Y<Z<T。R与T原子最外层电子数均是电子层数的2倍,R与T分别是碳和硫。Y元素能与大多数金属和非金属元素形成化合物,Y是氧。相应地,X是氮。Z+与Y2-电子层结构相同,Z是钠。A. Y、Z组成的化合物Na2O2含有离子键和共价键,故A错误;B. R的氢化物就是烃,不同烃沸点高低不同,有的烃沸点高于X、Y的氢化物,故B错误;C. 强酸硫酸酸性强于弱酸碳酸,所以T的最高价氧化物的水化物酸性比R的强,故C正确;D. Y和Z分别与T、X组成的二元化合物的水溶液不一定呈中性,如NO2、SO2的水溶液呈酸性,故D错误。故选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上用铋酸钠(NaBiNO3)检验溶液中的Mn2+,反应方程式为:4MnSO4+10NaBiO3+14H2SO4═4NaMnO4+5Bi2(SO4)3+3Na2SO4+口,下列说法不正确的是
A. 口内的物质为水,配平系数为14。
B. 若生成1mol NaMnO4,则转移5mole-
C. 反应方程式中的硫酸可换为盐酸
D. 溶液中有Mn2+的现象是溶液变为紫红色
-
科目: 来源: 题型:
查看答案和解析>>【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
CrO42﹣ Cr2O72﹣
Cr2O72﹣ 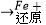 Cr3+
Cr3+ 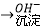 Cr(OH)3↓
Cr(OH)3↓
己知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )
A.转化过程中,增大c(H+),平衡向正反应方向移动,CrO42﹣的转化率提高
B.常温下Ksp[Cr(OH)3]=1×10﹣32 , 要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
C.若用绿矾(FeSO47H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
D.常温下转化反应的平衡常数K=104 , 则转化后所得溶液的pH=1 -
科目: 来源: 题型:
查看答案和解析>>【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4==FeSO4+Cu。有关该反应的说法正确的是 ( )
A. Fe是氧化剂 B. CuSO4是还原剂
C. Fe被氧化 D. CuSO4发生氧化反应
-
科目: 来源: 题型:
查看答案和解析>>【题目】温室下,用0.1molL﹣1NaOH溶液分别滴定体积均为20ml浓度均为0.1molL﹣1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
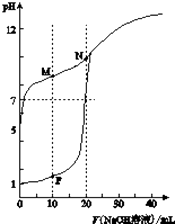
A.HX为弱酸
B.M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+)
C.将P点和N点的溶液为混合,呈酸性
D.向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣) -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质既属于钠盐,又属于含氧酸盐的是( )
A.Na2SO4B.NaClC.K2SO4D.NaOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】设NA为阿伏加德罗常数的值,下列说法确的是
A. 常温下,22gCO2所含的共用电子对数目为NA
B. 标准状况下,22.4LNO 与11.2LO2混合后气体中分子总数小于NA
C. 将1 L 0.1mol/L FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,1L0.5mol/L NH4Cl溶液与2L0.25mol/L NH4Cl溶液中的NH4+数目相同
相关试题

