【题目】设NA为阿伏加德罗常数的值,下列说法确的是
A. 常温下,22gCO2所含的共用电子对数目为NA
B. 标准状况下,22.4LNO 与11.2LO2混合后气体中分子总数小于NA
C. 将1 L 0.1mol/L FeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目为0.1NA
D. 常温下,1L0.5mol/L NH4Cl溶液与2L0.25mol/L NH4Cl溶液中的NH4+数目相同
参考答案:
【答案】B
【解析】A. CO2分子含有4个共价键即4对共用电子对,22g即0.5molCO2所含的共用电子对数目为2NA,故A错误;B. 标准状况下,22.4L即1molNO与11.2L即0.5molO2混合后,2NO+O2![]() 2NO2,2NO2
2NO2,2NO2![]() N2O4,所得气体中分子总数小于NA,故B正确;C. Fe(OH)3胶粒是许多Fe(OH)3分子的集合体,所以将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目小于0.1NA,故C错误;D. 稀释有利于盐类水解,常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液中的NH4+的水解程度,前者小于后者,所以NH4+数目前者大于后者,故D错误。故选B。
N2O4,所得气体中分子总数小于NA,故B正确;C. Fe(OH)3胶粒是许多Fe(OH)3分子的集合体,所以将1L0.1mol/LFeCl3溶液滴入沸水中,制得的Fe(OH)3胶粒数目小于0.1NA,故C错误;D. 稀释有利于盐类水解,常温下,1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液中的NH4+的水解程度,前者小于后者,所以NH4+数目前者大于后者,故D错误。故选B。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有短周期元素R、X、Y、Z、T,R与T原子最外层电子数均是电子层数的2倍,Y元素能与大多数金属和非金属元素形成化合物;Z+与Y2-电子层结构相同。五种元素的原子半径如图所示,下列推断正确的是

A. Y、Z组成的化合物只含离子键
B. 氢化物的沸点:R<X<Y
C. T的最高价氧化物的水化物酸性比R的强
D. Y和Z分别与T、X组成的二元化合物的水溶液一定呈中性
-
科目: 来源: 题型:
查看答案和解析>>【题目】温室下,用0.1molL﹣1NaOH溶液分别滴定体积均为20ml浓度均为0.1molL﹣1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
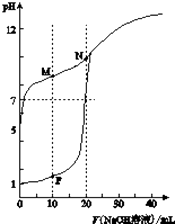
A.HX为弱酸
B.M点c(HX)﹣c(X﹣)>c(OH﹣)﹣c(H+)
C.将P点和N点的溶液为混合,呈酸性
D.向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl﹣)>c(X﹣) -
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质既属于钠盐,又属于含氧酸盐的是( )
A.Na2SO4B.NaClC.K2SO4D.NaOH
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,水溶液中H+和OH﹣的浓度变化曲线如图,下列说法正确的是( )
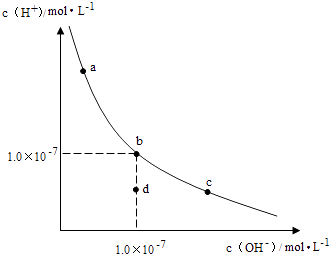
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10﹣13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化 -
科目: 来源: 题型:
查看答案和解析>>【题目】Fenton试剂常用于氧化降解有机污染物X。在一定条件下,反应初始时c(X)=2.0×10-3mol·L-1,反应10 min进行测定,得图1和图2。下列说法不正确的是
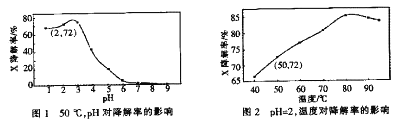
A. 50oC,PH在3~6之间,X降解率随pH增大而减小
B. pH=2,温度在40~80oC,X降解率随温度升高而增大
C. 无需再进行后续实验,就可以判断最佳反应条件是:PH=3、温度为80oC
D. pH=2、温度为50oC,10min内v(X)=1.44x10-4mol·L-1min-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】硅及其化合物在材料领域中应用广泛。下列叙述不正确的是
A. 硅单质可用来制造太阳能电池
B. 硅单质是制造玻璃的主要原料
C. 石英(SiO2)可用来制作工艺品
D. 二氧化硅是制造光导纤维的材料
相关试题

