【题目】某原电池的结构如图所示,下列有关该原电池的说法正确的是
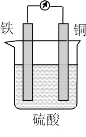
A. 该电池工作时电能转变为化学能 B. 铜片的质量增加
C. H+向铁片移动 D. 铁片上发生的反应是Fe-2e-=Fe2+
参考答案:
【答案】D
【解析】
该装置中,活动性强的Fe易失电子作负极,活动性弱的铜作正极,在负极上电极失电子发生氧化反应,在正极上溶液中的阳离子得电子发生还原反应,溶液中阳离子向正极移动,阴离子向正极移动,据此解答。
A.该装置为原电池,原电池工作时把化学能转化为电能,A错误;
B.铜作正极,正极上H+得电子生成H2逸出,所以铜片的质量不变,B错误;
C.溶液中阳离子向负电荷较多的正极移动,所以H+向铜片移动,C错误;
D.Fe易失电子作负极,铁片上发生的反应是Fe-2e-=Fe2+,D正确;
故合理选项是D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】元素周期表是学习化学的重要工具。下表为8种元素在周期表中的位置。

(1)如图所示的模型表示的分子中,可由A、D形成的是____。


c与氯气反应生成的二元取代物有____种,d分子的结构简式____。
(2)Na在F单质中燃烧产物的电子式为____。该燃烧产物中化学键的类型为:____。上述元素的最高价氧化物的水化物中,碱性最强的是____(写化学式)。
(3)A与D组成的化合物中,质量相同,在氧气中完全燃烧消耗氧气最多的是:____
(4)关于(1)中d分子有下列问题:
①d分子中同一平面的原子最多有____个。
②若用-C4H9取代d上的一个H原子,得到的有机物的同分异构体共有____种。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),其中正确的是 ( )
① pH=1的强酸溶液,加水稀释后,溶液中各离子浓度都会降低
② 1 L 0.50 mol·L-1NH4Cl 溶液与2 L 0.25 mol·L-1NH4Cl 溶液含NH4+ 物质的量完全相等
③ pH相等的四种溶液:a.CH3COONa b.NaClO c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d < b < c < a
④ pH=8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-)> c(H2CO3)
⑤ pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-) ≤ c(H+)
⑥ pH=4浓度均为0.1 mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-) > c(CH3COOH)+c(H+)
A. ③⑤⑥ B. ①③⑤ C. ①②④ D. ②④⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2
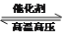 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
-
科目: 来源: 题型:
查看答案和解析>>【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.
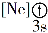 B.
B. C.
C. D.
D.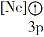
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
75.5
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


-
科目: 来源: 题型:
查看答案和解析>>【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
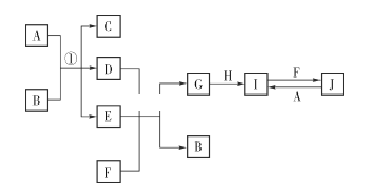
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组探究石蜡油分解产物,设计了如图实验方案。下列说法错误的是
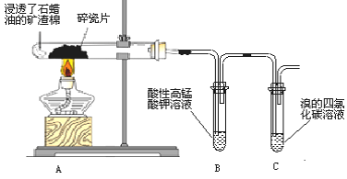
A.碎瓷片有催化和积蓄热量的作用
B.点燃C 出口处,火焰明亮,伴有黑烟
C.B、C 中溶液均褪色,反应类型相同
D.结束反应时,先撤出导管,再停止加热
相关试题

