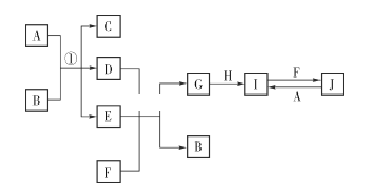
【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
参考答案:
【答案】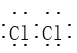 HCl Cu+2H2SO4(浓)
HCl Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O 2Fe3++Cu=2Fe2++Cu2+
CuSO4+SO2↑+2H2O 2Fe3++Cu=2Fe2++Cu2+
【解析】
A、H为常见的金属单质,其中A为紫红色金属,则A为Cu;F为黄绿色气体,则F为氯气;D与氯气反应生成B、G为两种常见的酸,且B能够与Cu反应生成C、D、E,则B为硫酸、D为二氧化硫、G为盐酸;金属H与盐酸反应生成I,I能够与氯气反应生成J,J能够与Cu反应生成I,则H为Fe,I为氯化亚铁、J为氯化铁,Cu与氯化铁的反应是电子工业常用于制电路板的反应。
(1)F为氯气,氯气是双原子分子,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)二氧化硫与氯气在溶液中反应生成硫酸和盐酸,硫酸能够与Cu反应,则B为硫酸,G为盐酸,故答案为:HCl;
(3)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫和水,反应的方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)I为氯化亚铁、J为氯化铁,铁离子与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故答案为:2Fe3++Cu═2Fe2++Cu2+。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定条件下将1 mol N2和3 mol H2置于密闭容器中发生反应N2+3H2
 2NH3(正反应是放热反应)。下列关于该反应的说法正确的是
2NH3(正反应是放热反应)。下列关于该反应的说法正确的是A. 降低温度可以加快反应速率
B. 达到化学反应限度时,生成2mol NH3
C. 向容器中再加入N2可以加快反应速率
D. 1mol N2 和3mol H2的总能量低于2mol NH3的总能量
-
科目: 来源: 题型:
查看答案和解析>>【题目】某原电池的结构如图所示,下列有关该原电池的说法正确的是
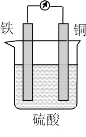
A. 该电池工作时电能转变为化学能 B. 铜片的质量增加
C. H+向铁片移动 D. 铁片上发生的反应是Fe-2e-=Fe2+
-
科目: 来源: 题型:
查看答案和解析>>【题目】在普通铝中加入少量Cu和Mg后,形成一种称为拉维斯相的MgCu2微小晶粒,其分散在Al中可使得铝材的硬度增加、延展性减小,形成所谓“坚铝”,是制造飞机的主要村料。回答下列问题:
(1)下列状态的镁中,电离最外层一个电子所需能量最大的是____________(填标号)。
A.
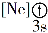 B.
B. C.
C. D.
D.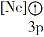
(2)乙二胺(H2NCH2CH2NH2)是一种有机化合物,分子中氮、碳的杂化类型分别是__________、__________。乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是__________,其中与乙二胺形成的化合物稳定性相对较高的是__________(填“Mg2+”或“Cu2+”)。
(3)一些氧化物的熔点如下表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/°C
1570
2800
23.8
75.5
解释表中氧化物之间熔点差异的原因__________。
(4)图(a)是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图(b)是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离x=__________pm,Mg原子之间最短距离y=__________pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是__________g·cm3(列出计算表达式)。


-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组探究石蜡油分解产物,设计了如图实验方案。下列说法错误的是
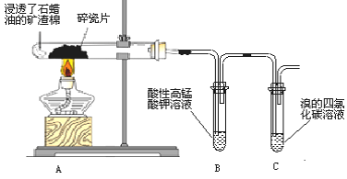
A.碎瓷片有催化和积蓄热量的作用
B.点燃C 出口处,火焰明亮,伴有黑烟
C.B、C 中溶液均褪色,反应类型相同
D.结束反应时,先撤出导管,再停止加热
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
-
科目: 来源: 题型:
查看答案和解析>>【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
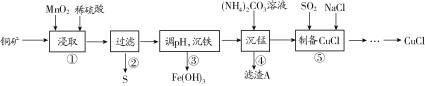
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质
开始沉淀
沉淀完全
Fe(OH)3
2.7
3.7
Mn(OH)2
7.1
10.1
Cu(OH)2
4.7
6.7
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。
相关试题

