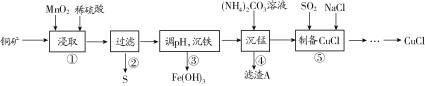
【题目】用某铜矿(含CuS以及少量FeO和Fe2O3)制备CuCl的主要流程如下:
已知Fe3+、Mn2+、Cu2+生成氢氧化物沉淀时的pH如下表所示:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Mn(OH)2 | 7.1 | 10.1 |
Cu(OH)2 | 4.7 | 6.7 |
(1)浸取时,CuS被浸取的离子方程式为CuS+MnO2+4H+=Cu2++Mn2++S↓+2H2O,该反应的氧化剂是________(填化学式),Fe2O3被浸取的离子方程式为________________。
(2)步骤③调整pH的范围为______,滤渣A的成分为________(填化学式)。
(3)“沉铁”时,需要检验Fe3+是否沉淀完全,所用的试剂为________(填化学式)。
(4)准确称取所制备的氯化亚铜样品1.600 g,将其置于足量的FeCl3溶液中,待样品完全溶解后,加入适量稀硫酸,用0.100 0 mol·L-1的K2Cr2O7溶液滴定到终点,消耗K2Cr2O7溶液25.00 mL,反应中Cr2O72-被还原为Cr3+,计算样品中CuCl的质量分数(写出计算过程)______。
参考答案:
【答案】MnO2 Fe2O3+6H+===2Fe3++3H2O 3.7<pH<4.7 MnCO3 KSCN 93.3%
【解析】
由流程图可知,铜矿(含CuS、Cu2S、CuO以及杂质FeO、Fe2O3)中加入稀硫酸、二氧化锰,CuS和二氧化锰、稀硫酸发生氧化还原反应,反应的离子反应方程式为CuS+MnO2+4H+=Cu2++Mn2++S+2H2O,Cu2S、CuO以及杂质FeO、Fe2O3分别与稀硫酸反应离子方程式为Cu2S+2H+=Cu+Cu2++H2S↑、CuO+2H+=Cu2++H2O、FeO+2H+=Fe2++H2O、Fe2O3+6H+=2Fe3++3H2O;调节滤液pH,溶液中铁离子生成Fe(OH)3沉淀;过滤,向滤液中加入碳酸铵溶液,锰离子与碳酸根反应生成MnCO3沉淀,过滤得到MnCO3沉淀;向滤液中加入氯化钠,通入二氧化硫,硫酸铜与氯化钠、二氧化硫发生反应生成氯化亚铜,反应的化学方程式为2CuSO4+2NaCl+SO2+2H2O =2CuCl↓+Na2SO4+2H2SO4。
(1)由方程式可知,浸取时CuS中Cu元素和S元素化合价升高,被氧化,CuS为还原剂,MnO2中Mn元素化合价降低,被还原,MnO2为氧化剂;Fe2O3与稀硫酸反应生成硫酸铁和水,反应的离子方程式为Fe2O3+6H+=2Fe3++3H2O,故答案为:MnO2;Fe2O3+6H+=2Fe3++3H2O;
(2)步骤③目的是除去铁离子,溶液中铁离子生成Fe(OH)3沉淀应调节pH为3.7<pH<4.7,以避免生成氢氧化铜;向滤液中加入碳酸铵溶液,锰离子与碳酸根反应生成MnCO3沉淀,过滤得到MnCO3,故答案为:3.7<pH<4.7;MnCO3;
(3)可用KSCN溶液检验铁离子,方法是取少量上层清液少许于试管中,向其中滴加KSCN溶液,若溶液不显红色,则表明已沉淀完全,故答案为:KSCN;
(4)由得失电子数目守恒可得如下关系6CuCl~6Fe2+~Cr2O72-,n(CuCl)=6×0.1000molL-1×25.00mL×10-3LmL-1=1.500×10-2mol,m(CuCl)=99.5gmol-1×1.500×10-2mol=1.493g,则w(CuCl)=1.493g/1.600g×100%=93.3%,故答案为:93.3%。
-
科目: 来源: 题型:
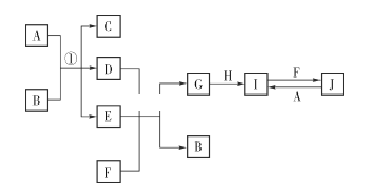
查看答案和解析>>【题目】在如图所示的物质转化关系中,A、H为常见的金属单质,其中A为紫红色金属;D、F为气体,其中F为黄绿色气体;B、G为两种常见的酸;由J生成I的反应是电子工业常用的反应。(部分生成物和反应条件未列出)
请回答下列问题:
(1)F的电子式为 ____________ 。
(2)G的化学式为 ____________。
(3)写出反应①的化学方程式:______________________________________________
(4)写出由J生成I的离子方程式:______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学兴趣小组探究石蜡油分解产物,设计了如图实验方案。下列说法错误的是
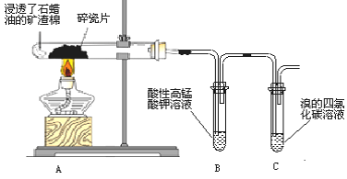
A.碎瓷片有催化和积蓄热量的作用
B.点燃C 出口处,火焰明亮,伴有黑烟
C.B、C 中溶液均褪色,反应类型相同
D.结束反应时,先撤出导管,再停止加热
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的流程如下:

下列说法错误的是( )
A. 向大气中排放SO2可能导致酸雨发生
B. 中和器中发生反应的离子方程式为HSO3-+OH-= SO32-+H2O
C. 检验Na2SO3成品中是否含Na2SO4,可选用稀盐酸和Ba(NO3)2溶液
D. 进入离心机的分散系是悬浊液
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列根据实验操作和现象所得出的结论不正确的是
选项
实验操作
实验现象
结论
A
向NaHS溶液中滴入酚酞
溶液变红色
HS-水解程度大于电离程度
B
向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水
出现蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
C
向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中
产生白色浑浊
酸性:盐酸>碳酸>硅酸
D
向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液
前者溶液变蓝色,后者有黄色沉淀
KI3溶液中存在I
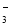
 I2+I平衡
I2+I平衡A. AB. BC. CD. D
-
科目: 来源: 题型:
查看答案和解析>>【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标况下2.24L的苯完全燃烧生成CO2的分子数目为0.6NA
B.7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.3NA个
C.18g的D2O含有的中子数目均为10NA
D.42g的C2H4与C3H6的混合物中含有的共价键数目为9 NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法正确的是
A.某单烯烃与H2 加成后的产物为(C2H5)2CHCH2C(CH3)3,则该烯烃可能的结构简式有5种
B.
 有机物的名称是2,4,4-三甲基戊烷
有机物的名称是2,4,4-三甲基戊烷C.甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯
D.沼气、油田气和可燃冰中均含有甲烷
相关试题

