【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )

A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
参考答案:
【答案】B
【解析】试题分析:A.根据在原电池中,阳离子移向正极,阴离子移向负极的规律,阴离子Cl-应由b区向a区迁移,错误;B.O2在液滴外沿反应,正极电极反应为:O2+2H2O+4e-=4OH-,发生还原反应,正确;C.液滴下的Fe因发生氧化反应而被腐蚀,错误;D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,由于Fe的金属活动性比铜强,Fe仍为负极,负极发生的电极反应为:Fe-2 e-=Fe2+,错误。
-
科目: 来源: 题型:
查看答案和解析>>【题目】部分中学化学常见元素的原子结构及性质如下表所示:
元素
结构及性质
A
A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5
B
B原子最外层电子数是内层电子总数的1/5
C
C是常见化肥的主要元素,单质常温下呈气态
D
D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质
E
通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物
F
F在周期表中可以排在IA族,也有人提出排在VIIA族
(1)A元素在周期表中的位置为第_____周期_____族。
(2)B与C形成的化合物的化学式为______,它属于____(填“离子”或“共价”)化合物。
(3)F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y。区别X与Y的水溶液的实验方法是_________________________________________。
(4)C与E都是较活泼的非金属元素,两者的非金属性强弱比较:_____>______(用化学符号回答),请例举出一个判断二者非金属性强弱的证据是____________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)_________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:镁电池的总反应为xMg+Mo3S4
 MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
A. 锂电池放电时,Mg2+向负极迁移
B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4
C. 理论上两种电池的比能量相同
D. 图中Li作负极,Mo3S4作阳极
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不属于有机物的是
A. 乙酸 B. 氰化钠(NaCN) C. 乙酸乙酯 D. 酒精
-
科目: 来源: 题型:
查看答案和解析>>【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
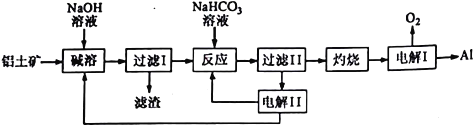
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)A1的原子结构示意图为_______________;A1与NaOH溶液反应的离子方程式为______________________________________。
(2) “碱溶”时生成偏铝酸钠的离子方程式为_______________________________。
(3)向” 过滤Ⅰ所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“ 不变”或“减小”)。
(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是__________________。
(5)”电解Ⅱ原理如图所示。
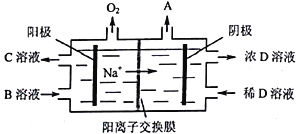
①试写出A、B、C、D物质的化学式:A_______,B_______,C_______,D_______。
②阳极的电极反应式为______________________________。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
A.钠的摩尔质量等于它的相对原子质量
B.CH4的摩尔质量为16 g/mol
C.22.4 L任何气体的物质的量均为1 mol
D.1 mol 任何物质均含有NA个分子 -
科目: 来源: 题型:
查看答案和解析>>【题目】一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(1)硼酸(H3BO3)为一元酸,硼酸中B的化合价为__________________。
(2)已知:Ka(H3BO3)=5.8×10-l0,Ka(H2CO3)=4.4×10-7,Ka(HCO3-)=4.7×10-l1,向饱和硼酸溶液中滴加0.1 molL-1Na2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。写出该反应的化学方程式____________________________________。
(3)以硼酸为原料可制备重要还原剂NaBH4,BH4-的电子式为______________。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是___________________________。
(4)硫酸溶解铁硼矿可制得含Fe3+、Fe2+、Al3+杂质的硼酸溶液,提纯过程中加入H2O2的目的是____________________,为除去Fe3+、Al3+ (使其浓度均小于1×10-6 mol·L-1),需至少调节pH=_________(已知: Ksp[Al(OH)3]= 1×10-33,Ksp[Fe(OH)3]=4×10-38)
(5)H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
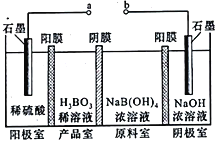
①a接电源的____________ (填“正极”、“ 负极”)
②写出阳极的电极反应式__________________________________。
③原料室中阴、阳离子是如何迁移的?_______________________________________。
相关试题

