【题目】铝是应用广泛的金属,以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
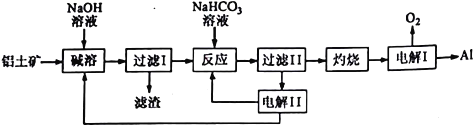
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)A1的原子结构示意图为_______________;A1与NaOH溶液反应的离子方程式为______________________________________。
(2) “碱溶”时生成偏铝酸钠的离子方程式为_______________________________。
(3)向” 过滤Ⅰ所得滤液中加入NaHCO3溶液,溶液的pH_________(填“增大”、“ 不变”或“减小”)。
(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是__________________。
(5)”电解Ⅱ原理如图所示。
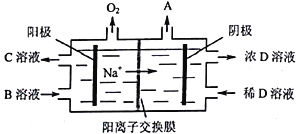
①试写出A、B、C、D物质的化学式:A_______,B_______,C_______,D_______。
②阳极的电极反应式为______________________________。
(6)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是________________________________。
参考答案:
【答案】 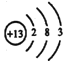 2Al+2H2O+2OH-=2AlO2-+3H2↑ Al2O3+2OH-= 2AlO2-+H2O 减小 石墨电极被阳极上产生的氧气氧化 H2 Na2CO3 NaHCO3 NaOH 【答题空10】【答题空10】4CO32-+2H2O4e-=4HCO3-+O2↑ 氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜
2Al+2H2O+2OH-=2AlO2-+3H2↑ Al2O3+2OH-= 2AlO2-+H2O 减小 石墨电极被阳极上产生的氧气氧化 H2 Na2CO3 NaHCO3 NaOH 【答题空10】【答题空10】4CO32-+2H2O4e-=4HCO3-+O2↑ 氯化铵分解产生的氯化氢能够破坏铝表面的氧化铝薄膜
【解析】(1)A1的原子结构示意图为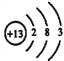 ;A1与NaOH溶液反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2 ↑;(2) “碱溶”时氧化铝与碱反应生成偏铝酸钠,离子方程式为:Al2O3+2OH-=2 AlO2-+H2O ;(3)过滤Ⅰ所得滤液中含有氢氧化钠、偏铝酸钠,当加入NaHCO3溶液,发生如下反应:OH- +HCO3-=CO32- +H2O,AlO2-+H2O+ HCO3-= CO32- +Al(OH)3↓,溶液的pH减小;(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,是因为生成的氧气与阳极材料碳反应;(5)由电解Ⅱ原理图中物质化合价变化、生成碳酸氢根离子等信息分析可知,①A是H2,B是 Na2CO3,C是NaHCO3,D是NaOH;②阳极的电极反应式为:4CO32-+2H2O4e-=4HCO3-+O2↑;(6)铝粉在1000℃时可与N2反应制备AlN是化合物,添加少量NH4Cl固体并充分混合,有利于AlN的制备,应该是氯化铵起作用,但在在1000℃环境中,氯化铵分解为氯化氢能够破坏铝表面的氧化铝薄膜而促进化合更易进行。
;A1与NaOH溶液反应的离子方程式为:2Al+2H2O+2OH-=2AlO2-+3H2 ↑;(2) “碱溶”时氧化铝与碱反应生成偏铝酸钠,离子方程式为:Al2O3+2OH-=2 AlO2-+H2O ;(3)过滤Ⅰ所得滤液中含有氢氧化钠、偏铝酸钠,当加入NaHCO3溶液,发生如下反应:OH- +HCO3-=CO32- +H2O,AlO2-+H2O+ HCO3-= CO32- +Al(OH)3↓,溶液的pH减小;(4) “电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,是因为生成的氧气与阳极材料碳反应;(5)由电解Ⅱ原理图中物质化合价变化、生成碳酸氢根离子等信息分析可知,①A是H2,B是 Na2CO3,C是NaHCO3,D是NaOH;②阳极的电极反应式为:4CO32-+2H2O4e-=4HCO3-+O2↑;(6)铝粉在1000℃时可与N2反应制备AlN是化合物,添加少量NH4Cl固体并充分混合,有利于AlN的制备,应该是氯化铵起作用,但在在1000℃环境中,氯化铵分解为氯化氢能够破坏铝表面的氧化铝薄膜而促进化合更易进行。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:镁电池的总反应为xMg+Mo3S4
 MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
A. 锂电池放电时,Mg2+向负极迁移
B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4
C. 理论上两种电池的比能量相同
D. 图中Li作负极,Mo3S4作阳极
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不属于有机物的是
A. 乙酸 B. 氰化钠(NaCN) C. 乙酸乙酯 D. 酒精
-
科目: 来源: 题型:
查看答案和解析>>【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )

A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列叙述正确的是( )
A.钠的摩尔质量等于它的相对原子质量
B.CH4的摩尔质量为16 g/mol
C.22.4 L任何气体的物质的量均为1 mol
D.1 mol 任何物质均含有NA个分子 -
科目: 来源: 题型:
查看答案和解析>>【题目】一些硼化合物在工业上有许多用途。以铁硼矿为原料可以制得硼酸及其他硼化合物。回答下列问题:
(1)硼酸(H3BO3)为一元酸,硼酸中B的化合价为__________________。
(2)已知:Ka(H3BO3)=5.8×10-l0,Ka(H2CO3)=4.4×10-7,Ka(HCO3-)=4.7×10-l1,向饱和硼酸溶液中滴加0.1 molL-1Na2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。写出该反应的化学方程式____________________________________。
(3)以硼酸为原料可制备重要还原剂NaBH4,BH4-的电子式为______________。NaBH4与BF3在50℃~70℃反应生成NaBF4和乙硼烷(B2H6),该反应的化学方程式是___________________________。
(4)硫酸溶解铁硼矿可制得含Fe3+、Fe2+、Al3+杂质的硼酸溶液,提纯过程中加入H2O2的目的是____________________,为除去Fe3+、Al3+ (使其浓度均小于1×10-6 mol·L-1),需至少调节pH=_________(已知: Ksp[Al(OH)3]= 1×10-33,Ksp[Fe(OH)3]=4×10-38)
(5)H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
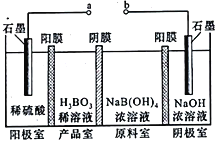
①a接电源的____________ (填“正极”、“ 负极”)
②写出阳极的电极反应式__________________________________。
③原料室中阴、阳离子是如何迁移的?_______________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】BaCO3与稀硝酸反应,正确的离子方程式是( )
A.Ba2++CO32﹣+2H+=Ba(NO3)2+H2O+CO2↑
B.BaCO3+2H+=Ba2++H2O+CO2↑
C.BaCO3+2H++2NO3﹣=Ba(NO3)2+H2O+CO2↑
D.CO32﹣+2H+=H2O+CO2↑
相关试题

