【题目】部分中学化学常见元素的原子结构及性质如下表所示:
元素 | 结构及性质 |
A | A单质是生活中的常见金属,它有两种氯化物,相对分子质量相差35.5 |
B | B原子最外层电子数是内层电子总数的1/5 |
C | C是常见化肥的主要元素,单质常温下呈气态 |
D | D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质 |
E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
F | F在周期表中可以排在IA族,也有人提出排在VIIA族 |
(1)A元素在周期表中的位置为第_____周期_____族。
(2)B与C形成的化合物的化学式为______,它属于____(填“离子”或“共价”)化合物。
(3)F与E可以形成原子个数比分别为2:1、1:1的两种化合物X和Y。区别X与Y的水溶液的实验方法是_________________________________________。
(4)C与E都是较活泼的非金属元素,两者的非金属性强弱比较:_____>______(用化学符号回答),请例举出一个判断二者非金属性强弱的证据是____________________。
(5)有人认为B、D的单质用导线连接后插入NaOH溶液中可以形成原电池,你认为是否可以,若可以,试写出负极的电极方程式(若认为不行可不写)_________________。
参考答案:
【答案】 四 Ⅷ Mg3N2 离子 分别取两种待测液于试管中,加入少量的MnO2粉末,观察有大量气体生成的为H2O2 O>N 4NH3+3O2![]() 2N2+6H2O其他合理答案也行 Al+4OH--3e-=AlO2-+2H2O
2N2+6H2O其他合理答案也行 Al+4OH--3e-=AlO2-+2H2O
【解析】
A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5,则A为Fe元素;B元素原子最外层电子数是内层电子总数的1/5,B有3个电子层,最外层电子数为2,则B为Mg元素;C是常见化肥的主要元素,单质常温下呈气态,C为N元素;D是地壳中含量最丰富的金属元素,工业上可通过电解法获取其单质,则D为Al;F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族,其化合价表现+1、-1,故F为H元素;通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物,则E为O元素,据此解答。
根据以上分析可知A为Fe,B为Mg,C为N,D为Al,E为O,F为H。则
(1)铁元素在周期表中的位置为第四周期第Ⅷ族
(2)Mg与N元素形成的化合物的化学式为Mg3N2,它属于离子化合物;
(3)H与O元素可以形成原子个数比分别为2:1、1:1的两种化合物X和Y,则X为H2O、Y为H2O2,双氧水易分解,因此区别X与Y的水溶液的实验方法是:分别取两种待测液于试管中,加入少量的MnO2粉末,观察有大量气体生成的为H2O2;
(4)同周期自左向右非金属性逐渐增强,则氧元素非金属性强于氮元素。利用氧化剂的氧化性处于氧化产物的氧化性,可以说明单质氧化性强弱,即表明氮气、氧气的氧化性强弱的方程式为4NH3+3O2![]() 2N2+6H2O;
2N2+6H2O;
(5)Mg、Al的单质用导线连接后插入NaOH溶液中,铝与氢氧化钠反应生成偏铝酸钠与氢气,可以形成原电池,铝发生氧化反应,故负极上Al失去电子,碱性条件下生成偏铝酸根离子与水,负极电极反应式为Al+4OH--3e-=AlO2-+2H2O。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列各有机物的名称错误的是
A. 3-甲基-2-戊烯 B. 3-甲基-2-丁烯
C. 2,2—二甲基丙烷 D. 3-甲基-1-丁烯
-
科目: 来源: 题型:
查看答案和解析>>【题目】对反应:aA(g)+bB(g)
 cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是
cC(g)+dD(g) ΔH,反应特点与对应的图象的说法中不正确的是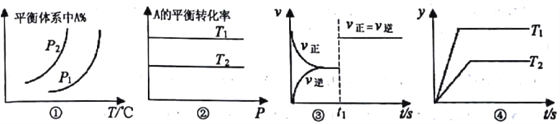
A. 图①中,若P1>P2,则该反应在较低温度下有利于自发进行
B. 图②中,若T2>T1,则△H<0 且a+b=c+d
C. 图③中t1时刻改变的条件一定是使用了催化剂
D. 图④中,若△H<0,则纵坐标不可能表示的是反应物的转化率
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质中属于纯净物、化合物、无机化合物、盐、钙盐的是( )
A.石灰石
B.Ca(OH)2
C.CaCO3
D.CH4 -
科目: 来源: 题型:
查看答案和解析>>【题目】已知:镁电池的总反应为xMg+Mo3S4
 MgxMo3S4,锂硫电池的总反应为2Li+S
MgxMo3S4,锂硫电池的总反应为2Li+S Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
Li2S。参与电极反应的单位质量的电极材料放出电能的大小称为该电池的比能量。下列说法正确的是
A. 锂电池放电时,Mg2+向负极迁移
B. 镁电池放电时,正极发生的电极反应为Mo3S4+xMg2++2xe-==MgxMo3S4
C. 理论上两种电池的比能量相同
D. 图中Li作负极,Mo3S4作阳极
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质不属于有机物的是
A. 乙酸 B. 氰化钠(NaCN) C. 乙酸乙酯 D. 酒精
-
科目: 来源: 题型:
查看答案和解析>>【题目】将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )

A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
相关试题

