【题目】汽车尾气净化原理为2NO(g)+2CO(g)N2(g)+2CO2(g)ΔH=-746.5kJ·mol-1,如图为在不同初始浓度的CO和不同催化剂Ⅰ、Ⅱ作用下(其他条件相同),体积为2L的密闭容器中n(N2)随反应时间的变化曲线,下列说法正确的是( )
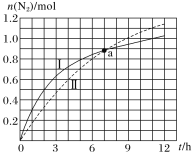
A.a点时,催化剂Ⅰ、Ⅱ作用下CO的转化率相等
B.0~6h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的好
C.0~5h内,催化剂Ⅰ作用下CO的反应速率为0.32mol·L-1·h-1
D.0~12h内,催化剂Ⅱ作用下反应放出的热量比催化剂Ⅰ的多
参考答案:
【答案】BD
【解析】
A.CO起始量不同,a点时生成N2的物质的量相同,所以CO转化率不同,故说法A错误;
B.由图像中曲线的变化趋势可知,反应达到平衡时,I曲线对应N2物质的量小于II曲线,催化剂并不会该变化学平衡,增大CO浓度,会使平衡向正反应方向移动,N2的物质的量增大,由此可知,I曲线对应CO初始浓度小于II曲线,但0~6h内,I曲线对应N2物质的量的变化量大于II曲线,说明催化剂Ⅰ的催化效果比催化剂Ⅱ的好,故B说法正确;
C.由图像可知,0~5h内,催化剂Ⅰ作用下生成N2的物质的量为0.8mol,根据化学计量数可知,消耗CO的物质的量为1.6mol,则0~5h内,催化剂Ⅰ作用下CO的反应速率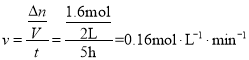 ,故C说法错误;
,故C说法错误;
D.由图像可知,0~12h内,催化剂Ⅱ作用下生成的N2物质的量高于催化剂Ⅰ,该反应正向为放热反应,反应物放出的热量与生成物的物质的量成正比,因此,0~12h内,催化剂Ⅱ作用下反应放出的热量比催化剂Ⅰ的多,故D说法正确;
综上所述,说法正确的是BD,故答案为:BD。
-
科目: 来源: 题型:
查看答案和解析>>【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
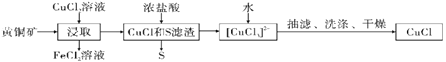
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)
 [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuClD.为提高产率和纯度,可采用乙醇洗涤、真空干燥
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图,甲是利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中错误的是( )
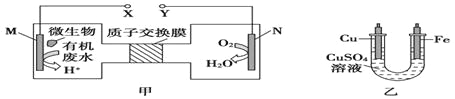
A.乙装置中溶液颜色不变
B.铜电极应与Y相连接
C.M电极反应式:CO(NH2)2+H2O-6e-=CO2↑+N2↑+6H+
D.当N电极消耗0.25mol气体时,铜电极质量减少16g
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列常见分子中的化学键判断正确的是( )
A.CN-与N2结构相似,[Fe(CN)6]3-中配位键和π键的个数之比为2∶1
B.CH3CH2CH2OH分子中极性键与非极性键数目之比为8∶1
C.
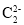 与
与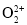 互为等电子体,1mol
互为等电子体,1mol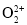 中含有的π键数目为2NA
中含有的π键数目为2NAD.已知反应N2O4(l)+2N2H4(l)=3N2(g)+4H2O(l),若该反应中有4molN—H键断裂,则形成的π键数目为6NA
-
科目: 来源: 题型:
查看答案和解析>>【题目】Cu2O广泛用作颜料和化工生产的催化剂。
Ⅰ.制备Cu2O
(1)电解法:工业上用铜作阳极,钛片为阴极,电解一定浓度的NaOH 溶液可制备氧化亚铜,写出阳极的电极反应式为_____________________
(2)微乳液-还原法:在 100℃ Cu(NO3)2 的水溶液中加入一定体积的 NaOH 水溶液,并搅拌使之混合均匀, 再逐滴加入水合肼的水溶液,直至产生红色沉淀,经抽滤、洗涤和真空干燥,得到Cu2O 粉末。
已知: N2H4(l)+O2(g)=N2(g)+2H2O(l)△H= -akJ/mol
Cu(OH)2(s)=CuO(s)+H2O(l)△H= +bkJ/mol
4CuO(s)=2Cu2O(s)+O2(g)△H= +ckJ/mol
则由N2H4 和Cu(OH)2 反应制备 Cu2O 的热化学方程式为 ________________________。
Ⅱ.工业上用Cu2O 与 ZnO 组成的催化剂可用于工业上合成甲醇: CO(g)+2H2(g)
 CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:
CH3OH(g) △H = -90.8 kJ/mol,回答下列问题:(1)能说明反应CO(g)+2H2(g)
 CH3OH(g)已达平衡状态的是(_______)
CH3OH(g)已达平衡状态的是(_______)A.当反应的热效应△H = -90.8 kJ/mol 时反应达到平衡状态
B.在恒温恒压的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒容的容器中,气体的平均摩尔质量不再变化
(2)在 T1℃时,体积为 2 L 的恒容容器中充入物质的量之和为 3mol 的 H2 和CO,当起始 n(H2)/n(CO)= 2 时,经过 5min 达到平衡,CO 的转化率为 0.6,则0~5min 内平均反应速率 v (H2)=___;该温度下的平衡常数为__________________ ;若此时再向容器中加入CO(g) 和 CH3OH(g)各 0.4mol,达新平衡时 H2 的转化率将 ______(填“增大”、 “减小”或“不变”);
(3)工业实际合成 CH3OH 生产中,采用下图M点而不是N点对应的反应条件,运用化学反应速率和化学平衡知识,同时考虑生产实际,说明选择该反应条件的理由:________。

-
科目: 来源: 题型:
查看答案和解析>>【题目】磷酸铁锂电池是绿色环保型电池,电池的总反应为:Li1-xFePO4+LixC6= LiFePO4+C6。
(1)LiFepO4中Fe2+的价电子排布图(轨道表达式)为___________,该电池反应物中涉及第二周期的元素的第一电离能由大到小的顺序是___________(用元素符号表示)。
(2)H3PO4和H2CO3中P和C原子的杂化方式_____(填“相同”或“不相同”)。PO43-的空间结构为___________。
(3)石墨可用作锂离子电池的负极材料,Li+嵌人石墨的两层间,导致石墨的层堆积方式发生改变,形成化学式为LixC6的嵌入化合物。某石墨嵌入化合物的平面结构如右图所示,则x=___________;若每个六元环都对应一个L i+,则化学式为___________。

(4)某金属锂的硼氢化物是优质固体电解质,并具有高储氢密度。阳离子为Li+,阴离子是由12个硼原子和12个氢原子所构成的离子团。阴离子在晶胞中位置如图所示,其堆积方式为___________,Li+占据阴离子组成的所有正四面体中心,该化合物的化学式为___________(用最简整数比表示)。假设晶胞边长为a nm,则两个最近的Li+的距离为___________nm。

-
科目: 来源: 题型:
查看答案和解析>>【题目】常温下含碳各微粒H2CO3、
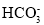 和
和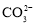 存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )
存在于CO2和NaOH溶液反应后的溶液中,其物质的量分数与溶液pH的关系如图所示,下列说法错误的是( )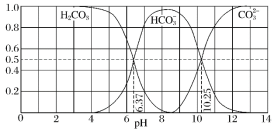
A.pH=10.25时,c(Na+)=c(
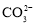 )+c(
)+c(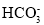 )
)B.为获得尽可能纯的NaHCO3,宜控制溶液的pH为7~9之间
C.根据图中数据,可以计算得到H2CO3第一步电离的平衡常数K1(H2CO3)=10-6.37
D.若是0.1molNaOH反应后所得的1L溶液,pH=10时,溶液中存在以下关系:c(Na+)>c(
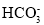 )>c(
)>c(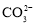 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
相关试题

