【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。
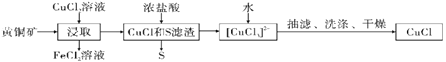
已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
[CuCl3]2-(aq)(无色溶液),下列叙述错误的是( )
A.浸取阶段,参加反应的CuFeS2和CuCl2的物质的量之比为3:l
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl
[CuCl3]2-(aq)平衡逆向移动,析出CuCl
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
参考答案:
【答案】AB
【解析】
黄铜矿和氯化铜反应生成氯化亚铜、氯化亚铁和硫单质,CuCl和盐酸反应生成[CuCl3]2-,加水稀释利用平衡移动原理CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq),平衡逆向移动,生成氯化亚铜。
[CuCl3]2-(aq),平衡逆向移动,生成氯化亚铜。
A. 浸取中的主要反应为CuFeS2+3CuCl2= 4CuCl+FeCl2+2S,参加反应的CuFeS2和CuCl2的物质的量之比为1:3,A项错误;
B. 浸取所得到的FeCl2溶液和铜不反应,B项错误;
C. 加水,反应物浓度减小更多,CuCl(s)+2Cl-(aq)![]() [CuCl3]2-(aq)平衡逆向移动,析出CuCl,C项正确;
[CuCl3]2-(aq)平衡逆向移动,析出CuCl,C项正确;
D. 因CuCl微溶于水,难溶于乙醇,在空气中易被氧化,为提高产率和纯度,因此采用乙醇洗涤、真空干燥CuCl,D项正确;
答案选AB。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硼酸(H3BO3)为弱酸,已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,H3BO3可以通过电解的方法制备。其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列说法错误的是( )
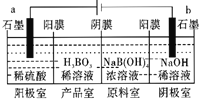
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.反应一段时间以后,阴极室NaOH溶液浓度增大,阳极室H2SO4浓度增大
C.当电路中通过3mol电子时,可得到1molH3BO3
D.电解过程中,B(OH)4-穿过阴膜进入产品窒,Na+穿过阳膜进入阴极室
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定条件下,可逆反应2A
 B+3C在下列四种状态中,处于平衡状态的是
B+3C在下列四种状态中,处于平衡状态的是A. 正反应速率vA=2 mol/(L·min),逆反应速率vB=2 mol/(L·min)
B. 正反应速率vA=2 mol/(L·min),逆反应速率vC=2 mol/(L·min)
C. 正反应速率vA=1 mol/(L·min),逆反应速率vB=1.5 mol/(L·min)
D. 正反应速率vA=1 mol/(L·min),逆反应速率vC=1.5 mol/(L·min)
-
科目: 来源: 题型:
查看答案和解析>>【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一固定体积的密闭容器中,加入2mol A和1mol B发生可逆反应2A(g)+B(g)3C(g)+D(g),达到平衡,C的浓度为w mol/L。若维持容器体积和温度不变,下列四种配比作为起始物质,达平衡后,C的浓度仍为w mol/L的是( )
A.4 mol A+2 mol B B.1 mol B+3 mol C+1 mol D
C.3 mol C+2 mol D D.1 mol A+0.5 mol B+1.5 mol C+0.5 mol D
-
科目: 来源: 题型:
查看答案和解析>>【题目】反应mA(s)+nB(g)
 pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是
pC(g) △H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是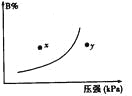
①m+n>p ②y点表示的正反应速率小于逆反应速率
③n>p ④x点比y点时的反应速率慢
⑤若降低温度,该反应的平衡常数增大
A.①②⑤B.②④⑤
C.只有①③D.①③⑤
-
科目: 来源: 题型:
查看答案和解析>>【题目】某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示。由图中数据该反应的化学方程式为:________。反应开始至2min,Z的平均反应速率为________

相关试题

