【题目】氮是第二周期VA族元素,形成的[Cu(NH3)4](OH)2、N2H4、NH3等多种含氮化合物有着厂之的用途。回答下列问题,
(1)画出氮的原子结构示意图:___________。
(2)制备铜氨溶液的方法有多种,其中一种的反应原理为:Cu(OH)2(s)+2NH3·H2O+ 2NH4+![]() [Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为________,其原因是__________。
[Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为________,其原因是__________。
(3)肼(N2H4)又称联氨,常温下是一种可燃性液体,其燃烧热较大且产物对环境无污染,常用作火箭燃料。
已知:N2(g)+O2(g)=2NO(g) ΔH1;
2NO(g)+O2(g)=2NO2(g) ΔH2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
则反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=_____(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(4)某温度下,分别向三个体积为20L的密闭容器中充入1molN2和2.6molH2分别保持恒温恒容、恒温恒压和绝热恒容,均发生反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N的转化率(α)与反应时间(t)的关系如图所示。
2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N的转化率(α)与反应时间(t)的关系如图所示。

①下列表示恒容时反应已达到平衡状态的是______ (填字母)
A.氨气的浓度不再变化
B.x(H2)=3v(N2)
C.c(N2)/c(NH3)的值不再变化
D.α(N2)=16.7%
②图中代表反应在绝热恒容容器中进行的曲线是______(填“a”“b”或“c”)。
③b容器中,M点v正_____(填“大于”“小于”或“等于”)v逆。
④曲线a代表的条件下该反应的平衡常数K=__________。
参考答案:
【答案】 ![]() 固体溶解,得到深蓝色溶液 加入硫酸铵固体,增大了NH4+的浓度,使上述平衡向生成铜氨离子的方向移动 1/2(ΔH1+ΔH2+ΔH3) AC c 大于 10
固体溶解,得到深蓝色溶液 加入硫酸铵固体,增大了NH4+的浓度,使上述平衡向生成铜氨离子的方向移动 1/2(ΔH1+ΔH2+ΔH3) AC c 大于 10
【解析】(1)氮为7号元素,其原子结构示意图为:![]() ;(2) 制备铜氨溶液的方法有多种,其中一种的反应原理为:Cu(OH)2(s)+2NH3·H2O+ 2NH4+
;(2) 制备铜氨溶液的方法有多种,其中一种的反应原理为:Cu(OH)2(s)+2NH3·H2O+ 2NH4+![]() [Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为固体溶解,得到深蓝色溶液,其原因是加入硫酸铵固体,增大了NH4+的浓度,使上述平衡向生成铜氨离子的方向移动;(3)已知:①N2(g)+O2(g)=2NO(g) ΔH1;
[Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为固体溶解,得到深蓝色溶液,其原因是加入硫酸铵固体,增大了NH4+的浓度,使上述平衡向生成铜氨离子的方向移动;(3)已知:①N2(g)+O2(g)=2NO(g) ΔH1;
②2NO(g)+O2(g)=2NO2(g) ΔH2;
③2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
根据盖斯定律,由![]() 得反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=
得反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=![]() (ΔH1+ΔH2+ΔH3);(4) ①A.氨气的浓度不再变化,说明反应已达平衡状态,选项A正确;B.没有说明正逆反应速率,反应一开始就一直按v(H2)=3v(N2)这种关系进行,无法说明反应达平衡状态,选项B错误;C.c(N2)/c(NH3)的值不再变化,则各反应物的浓度不再变化,反应达到平衡状态,选项C正确;D.α(N2)=16.7%,没有说明是哪个容器的反应,不一定达到平衡状态,选项D错误。答案选AC;②反应:N2(g)+3H2(g)
(ΔH1+ΔH2+ΔH3);(4) ①A.氨气的浓度不再变化,说明反应已达平衡状态,选项A正确;B.没有说明正逆反应速率,反应一开始就一直按v(H2)=3v(N2)这种关系进行,无法说明反应达平衡状态,选项B错误;C.c(N2)/c(NH3)的值不再变化,则各反应物的浓度不再变化,反应达到平衡状态,选项C正确;D.α(N2)=16.7%,没有说明是哪个容器的反应,不一定达到平衡状态,选项D错误。答案选AC;②反应:N2(g)+3H2(g)![]() 2NH3(g) ΔH<0为气体体积缩小的放热反应,开始投料为氮气和氢气,则恒温恒压反应进行容器体积变小相当于增大压强,平衡向正方向进行,氮气的转化率最大,为a;反应放热,绝热恒容体系温度升高,与恒温恒容比平衡向逆反应方向移动,氮气的转化率降低,为c;③b容器中,M点反应还没达平衡,还在向正方向进行,v正大于v逆;④对于同一反应,温度相同,平衡常数相同,故曲线a代表的条件下该反应的平衡常数K与曲线b的相同,b中氮气的平衡转化率为20%,故
2NH3(g) ΔH<0为气体体积缩小的放热反应,开始投料为氮气和氢气,则恒温恒压反应进行容器体积变小相当于增大压强,平衡向正方向进行,氮气的转化率最大,为a;反应放热,绝热恒容体系温度升高,与恒温恒容比平衡向逆反应方向移动,氮气的转化率降低,为c;③b容器中,M点反应还没达平衡,还在向正方向进行,v正大于v逆;④对于同一反应,温度相同,平衡常数相同,故曲线a代表的条件下该反应的平衡常数K与曲线b的相同,b中氮气的平衡转化率为20%,故
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
开始时的浓度(mol/L) 0.05 0.13 0
改变的浓度(mol/L) 0.01 0.03 0.02
平衡时的浓度(mol/L) 0.04 0.10 0.02
平衡常数![]() 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH
 CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
-
科目: 来源: 题型:
查看答案和解析>>【题目】容积固定的密闭容器中存在如下反应:A(g)+3B(g)
 2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
2C(g) △H<0某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出下列关系图:
下列判断正确的是
①图I研究的是压强对反应的影响,且乙的压强较高
②图II研究的是压强对反应的影响,且甲的压强较高
③图II研究的是温度对反应的影响,且乙的温度较高
④图III研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高
A. ①② B. ①③ C. ①④ D. ③④
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。
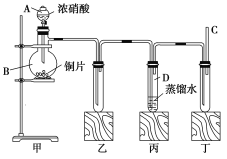
回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是_____,该装置中发生反应的化学方程式为___。
(2)实验过程中,装置乙、丙中出现的现象分别是__________、____________;装置丙中的试管内发生反应的离子方程式为________________(不是离子反应的不写)。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再向溶液中滴加KSCN溶液,溶液变为________色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知反应2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.44
0.6
0.6
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
-
科目: 来源: 题型:
查看答案和解析>>【题目】某位同学为验证SO2的化学性质,做了一系列实验,根据实验完成下列实验要求:
用铜与浓硫酸反应制得SO2,化学方程式为_____________________________。
(1)将SO2通入氢硫酸中,现象是__________,化学反应方程式为________________,这说明SO2具有________性。
(2)将SO2通入溴水中,现象是_________________,化学反应方程式为___________,说明SO2具有________性。
(3)将SO2通入品红溶液,现象是_______________,将生成的溶液加热煮沸,现象是________________,原因是____________________。
(4)将SO2通入NaOH溶液(含有酚酞指示剂)中,现象是________,化学方程式为________________,这说明SO2具有________性氧化物的性质。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
相关试题

