【题目】某位同学为验证SO2的化学性质,做了一系列实验,根据实验完成下列实验要求:
用铜与浓硫酸反应制得SO2,化学方程式为_____________________________。
(1)将SO2通入氢硫酸中,现象是__________,化学反应方程式为________________,这说明SO2具有________性。
(2)将SO2通入溴水中,现象是_________________,化学反应方程式为___________,说明SO2具有________性。
(3)将SO2通入品红溶液,现象是_______________,将生成的溶液加热煮沸,现象是________________,原因是____________________。
(4)将SO2通入NaOH溶液(含有酚酞指示剂)中,现象是________,化学方程式为________________,这说明SO2具有________性氧化物的性质。
参考答案:
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O溶液中有浅黄色沉淀生成2H2S+SO2===3S↓+2H2O氧化橙色褪去SO2+Br2+2H2O===2HBr+H2SO4还原红色褪去红色又恢复SO2与有色物质结合成无色物质,加热分解,又恢复原来颜色红色褪去SO2+2NaOH===Na2SO3+H2O(或SO2+NaOH===NaHSO3)酸
CuSO4+SO2↑+2H2O溶液中有浅黄色沉淀生成2H2S+SO2===3S↓+2H2O氧化橙色褪去SO2+Br2+2H2O===2HBr+H2SO4还原红色褪去红色又恢复SO2与有色物质结合成无色物质,加热分解,又恢复原来颜色红色褪去SO2+2NaOH===Na2SO3+H2O(或SO2+NaOH===NaHSO3)酸
【解析】
铜与浓硫酸在加热的条件下反应生成硫酸铜、水和SO2,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(1)二氧化硫具有氧化性,将SO2通入氢硫酸中把硫化氢氧化为单质硫,实验现象是溶液中有浅黄色沉淀生成,化学反应方程式为2H2S+SO2=3S↓+2H2O。
(2)二氧化硫具有还原性,将SO2通入溴水中,二氧化硫被溴水氧化,所以实验现象是溴水的橙色褪去,化学反应方程式为SO2+Br2+2H2O=2HBr+H2SO4。
(3)二氧化硫具有漂白性,能与有色物质结合成无色物质,因此将SO2通入品红溶液中的现象是红色褪去。由于二氧化硫的漂白作用不稳定,因此将生成的溶液加热煮沸又恢复原来颜色,即现象是红色又恢复。
(4)二氧化硫是酸性氧化物,能与强碱反应,所以将SO2通入NaOH溶液(含有酚酞指示剂)中与氢氧化钠反应生成亚硫酸钠或亚硫酸氢钠,因此现象是红色褪去,化学方程式为SO2+2NaOH=Na2SO3+H2O或SO2+NaOH=NaHSO3。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某学校化学学习小组为探究二氧化氮的性质,按如图所示装置进行实验。
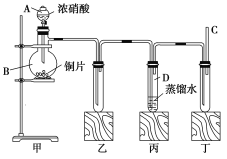
回答下列问题:
(1)装置甲中盛放浓硝酸的仪器A的名称是_____,该装置中发生反应的化学方程式为___。
(2)实验过程中,装置乙、丙中出现的现象分别是__________、____________;装置丙中的试管内发生反应的离子方程式为________________(不是离子反应的不写)。
(3)取下装置丙中的试管D,在其中滴加FeSO4溶液,溶液变为________色,为了证明铁元素在该反应中的产物,可以再向溶液中滴加KSCN溶液,溶液变为________色。
-
科目: 来源: 题型:
查看答案和解析>>【题目】氮是第二周期VA族元素,形成的[Cu(NH3)4](OH)2、N2H4、NH3等多种含氮化合物有着厂之的用途。回答下列问题,
(1)画出氮的原子结构示意图:___________。
(2)制备铜氨溶液的方法有多种,其中一种的反应原理为:Cu(OH)2(s)+2NH3·H2O+ 2NH4+
 [Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为________,其原因是__________。
[Cu(NH3)4]2+ (深蓝色)+ 4H2O.向盛有少量Cu(OH)2固体的试管中加入14 mol/L的氨水,得到悬浊液,此时若加入适量的硫酸铵固体,发生反应的现象为________,其原因是__________。(3)肼(N2H4)又称联氨,常温下是一种可燃性液体,其燃烧热较大且产物对环境无污染,常用作火箭燃料。
已知:N2(g)+O2(g)=2NO(g) ΔH1;
2NO(g)+O2(g)=2NO2(g) ΔH2;
2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g) ΔH3;
则反应:N2H4(g)+O2(g)=N2(g)+2H2O ΔH=_____(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(4)某温度下,分别向三个体积为20L的密闭容器中充入1molN2和2.6molH2分别保持恒温恒容、恒温恒压和绝热恒容,均发生反应:N2(g)+3H2(g)
 2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N的转化率(α)与反应时间(t)的关系如图所示。
2NH3(g) ΔH<0。三个容器(分别用a、b、c表示)中N的转化率(α)与反应时间(t)的关系如图所示。
①下列表示恒容时反应已达到平衡状态的是______ (填字母)
A.氨气的浓度不再变化
B.x(H2)=3v(N2)
C.c(N2)/c(NH3)的值不再变化
D.α(N2)=16.7%
②图中代表反应在绝热恒容容器中进行的曲线是______(填“a”“b”或“c”)。
③b容器中,M点v正_____(填“大于”“小于”或“等于”)v逆。
④曲线a代表的条件下该反应的平衡常数K=__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知反应2CH3OH(g)
 CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)某温度下的平衡常数为400。此温度下,在2 L的密闭容器中加入a mol CH3OH,反应到某时刻测得各组分的浓度如下:物质
CH3OH
CH3OCH3
H2O
浓度/(mol·L-1)
0.44
0.6
0.6
下列说法正确的是
A. 此时刻正反应速率大于逆反应速率
B. 若起始时加入2a mol CH3OH,则达到平衡时CH3OH的转化率增大
C. 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态
D. a=1.64
-
科目: 来源: 题型:
查看答案和解析>>【题目】某羧酸酯的分子式为C18H26O5,1mol该酯完全水解得到1mol羧酸和2mol乙醇,该羧酸的分子式为
A. C16H22O5 B. C14H16O4 C. C16H20O4 D. C14H18O5
-
科目: 来源: 题型:
查看答案和解析>>【题目】Cl2与CH4在光照条件下,按照体积比1:1反应,则生成的产物为
A.CH3ClB.CH2Cl2C.HClD.CH3Cl、CH2Cl2、CHCl3、CCl4、HCl
-
科目: 来源: 题型:
查看答案和解析>>【题目】氟及其化合物用途非常广泛。回答下列问题:
(1)基态氟原子的价电子排布式为_________________。
(2)C2F4可用于合成聚四氟乙烯,HBF4可用于蚀刻玻璃,NO2F可用作火箭推进剂中的氧化剂,NaAlF6可用作电冶铝的助培剂。
①C2F4分子中所含共价键的类型有_____,C2F4分子中碳原子的杂化轨道类型是____,聚四氟乙烯是一种准晶体,证明它不是晶体可用的实验方法是_______________。
②HF与BF3化合可得到HBF4,从价键形成角度分析HF与BF3能化合的原因_______________。
③与NO2F分子互为等电子的非极性分子有__________(写一个符合要求的化学式即可)。
(3)CaF2的晶体结构如图所示。
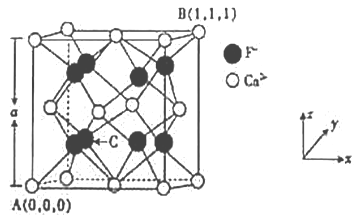
①CaF2晶胞中,Ca2+的配位数为_____;F-的配位数为_____。
②原子坐标参数可表示晶胞内部各原子的相对位置,已知A、B两点的原子坐标参数如图所示,则C点的原子坐标参数为______________。
③晶胞参数可描述晶胞的大小和形状,CaF2晶胞的晶胞参数。A=546.2pm,则其密度为_____(列出计算式即可)g/cm3。
相关试题

