第35页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
1. 相同质量的镁、铁、锌三种金属,分别与足量的、相同溶质质量分数的稀硫酸充分反应,生成氢气的质量与反应时间的关系如图所示。下列说法中,正确的是(
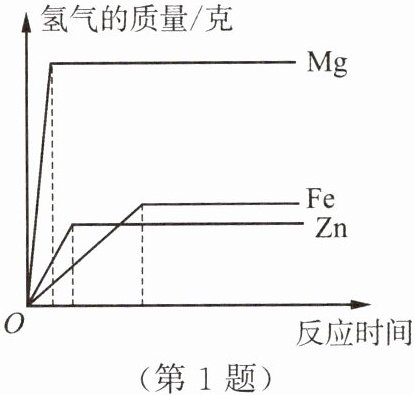
A.金属锌的反应速率最大
B.金属锌的活动性最强
C.金属镁生成的氢气最多
D.金属铁消耗的稀硫酸最多
C
)
A.金属锌的反应速率最大
B.金属锌的活动性最强
C.金属镁生成的氢气最多
D.金属铁消耗的稀硫酸最多
答案:
1.C
2. 金属与人类的生活密切相关,请回答下列有关金属性质的问题。
(1)铝较为活泼,为什么铝制品却能耐腐蚀?
(2)将过量的锌粉加入$AgNO_3$和$Mg(NO_3)_2$的混合溶液中,充分反应后过滤,过滤后留在滤纸上的固体是
(1)铝较为活泼,为什么铝制品却能耐腐蚀?
铝能与氧气反应,表面生成致密的氧化铝薄膜
。(2)将过量的锌粉加入$AgNO_3$和$Mg(NO_3)_2$的混合溶液中,充分反应后过滤,过滤后留在滤纸上的固体是
银和锌
。请写出有关反应的化学方程式:Zn+2AgNO₃══Zn(NO₃)₂+2Ag
。
答案:
2.
(1)铝能与氧气反应,表面生成致密的氧化铝薄膜
(2)固体是银和锌 Zn+2AgNO₃══Zn(NO₃)₂+2Ag
(1)铝能与氧气反应,表面生成致密的氧化铝薄膜
(2)固体是银和锌 Zn+2AgNO₃══Zn(NO₃)₂+2Ag
3. 比较锰、钯、铜的金属活动性顺序。
(1)将锰片、钯片分别加入稀盐酸中,锰片表面有气泡产生,钯片没有明显变化。根据上述实验现象,得出的结论是
(2)要得出锰、钯、铜的金属活动性顺序,还需将钯片加入
(1)将锰片、钯片分别加入稀盐酸中,锰片表面有气泡产生,钯片没有明显变化。根据上述实验现象,得出的结论是
锰的活动性大于钯
。(2)要得出锰、钯、铜的金属活动性顺序,还需将钯片加入
硫酸铜(或氯化铜、硝酸铜)
溶液中,观察现象。
答案:
3.
(1)锰的活动性大于钯
(2)硫酸铜(或氯化铜、硝酸铜)
(1)锰的活动性大于钯
(2)硫酸铜(或氯化铜、硝酸铜)
4. 铁制品经常会发生锈蚀现象,某兴趣小组围绕“锈”进行了一系列研究。
(1)探“锈”:现有洁净无锈的铁钉、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙,还有其他物品可供选用。为探究铁制品锈蚀的条件,兴趣小组设计了如下实验:
①A中玻璃仪器的名称是
②一周后,观察A、B、C中的铁钉,只有A中的铁钉出现了明显的锈蚀现象,由此得出铁钉锈蚀需要与
(2)除“锈”:取出生锈的铁钉,将其放置在稀盐酸中,一段时间后发现溶液变黄,铁钉表面有少量气泡产生。产生气泡的原因是
(3)防“锈”:要防止铁制品锈蚀,可以破坏其锈蚀的条件。常用的防锈方法有
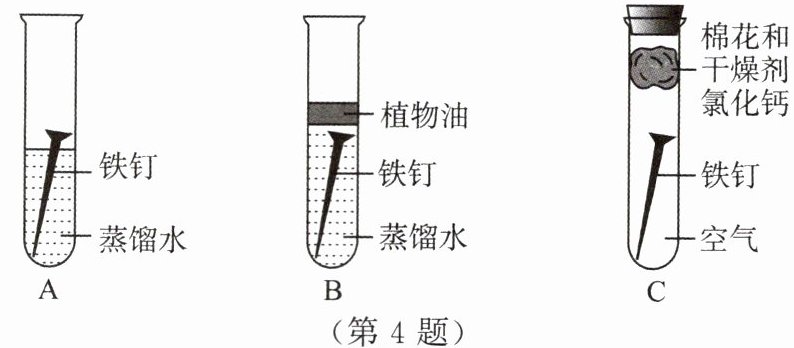
(1)探“锈”:现有洁净无锈的铁钉、经煮沸迅速冷却的蒸馏水、植物油、棉花和干燥剂氯化钙,还有其他物品可供选用。为探究铁制品锈蚀的条件,兴趣小组设计了如下实验:
①A中玻璃仪器的名称是
试管
。②一周后,观察A、B、C中的铁钉,只有A中的铁钉出现了明显的锈蚀现象,由此得出铁钉锈蚀需要与
氧气和水
接触的结论。(2)除“锈”:取出生锈的铁钉,将其放置在稀盐酸中,一段时间后发现溶液变黄,铁钉表面有少量气泡产生。产生气泡的原因是
Fe+2HCl══FeCl₂+H₂↑
(用化学方程式表示)。稀盐酸可用于除锈,但铁制品不可长时间浸泡其中。(3)防“锈”:要防止铁制品锈蚀,可以破坏其锈蚀的条件。常用的防锈方法有
表面刷漆、涂油等(合理即可)
(写一种即可)。该兴趣小组通过文献研究和调研访谈,发现如何防止金属锈蚀已成为科学研究和技术领域中的重要科研课题。
答案:
4.
(1)①试管 ②氧气和水
(2)Fe+2HCl══FeCl₂+H₂↑
(3)表面刷漆、涂油等(合理即可)
(1)①试管 ②氧气和水
(2)Fe+2HCl══FeCl₂+H₂↑
(3)表面刷漆、涂油等(合理即可)
查看更多完整答案,请扫码查看


