13. 阅读下列科技短文,回答问题。
中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉$[(C_6H_1₀O_5)ₙ]$。检测发现,人工合成淀粉分子与天然淀粉分子的结构组成一致。这一人工途径的淀粉合成速率是玉米淀粉合成速率的8.5倍。初步测试显示,在能量供给充足时,理论上1立方米大小的生物反应器年产淀粉量相当于我国5亩玉米地的平均年产淀粉量。这一突破为淀粉的车间生产打开一扇窗口,并为以二氧化碳为原料合成复杂分子开辟了新的技术路线。
(1)二氧化碳到淀粉的转变过程,是
(2)二氧化碳人工合成淀粉需要11步反应,其中第一步反应为$CO_2+3H_2\xlongequal[]{一定条件}X+CH_3OH$;第二步反应为$CH_3OH+O_2\xlongequal[]{一定条件}Y+HCHO$。写出物质Y的化学式:
(3)在制造淀粉的过程中使用了催化剂,催化剂在反应前后质量和
(4)下列有关说法正确的是
A. 人工合成淀粉可减缓粮食危机
B. 人工合成淀粉可降低空气中$CO_2$含量
C. 淀粉的相对分子质量为$162g$
D. 人工合成淀粉比玉米通过光合作用合成效率高
中国科学家首次实现了以二氧化碳为原料,不依赖植物光合作用,直接人工合成淀粉$[(C_6H_1₀O_5)ₙ]$。检测发现,人工合成淀粉分子与天然淀粉分子的结构组成一致。这一人工途径的淀粉合成速率是玉米淀粉合成速率的8.5倍。初步测试显示,在能量供给充足时,理论上1立方米大小的生物反应器年产淀粉量相当于我国5亩玉米地的平均年产淀粉量。这一突破为淀粉的车间生产打开一扇窗口,并为以二氧化碳为原料合成复杂分子开辟了新的技术路线。
(1)二氧化碳到淀粉的转变过程,是
化学
(填“物理”或“化学”)变化。(2)二氧化碳人工合成淀粉需要11步反应,其中第一步反应为$CO_2+3H_2\xlongequal[]{一定条件}X+CH_3OH$;第二步反应为$CH_3OH+O_2\xlongequal[]{一定条件}Y+HCHO$。写出物质Y的化学式:
$H_2O_2$
。物质X和Y的组成元素相同,但这两种物质化学性质不同的原因是分子构成不同
。(3)在制造淀粉的过程中使用了催化剂,催化剂在反应前后质量和
化学性质
不变。(4)下列有关说法正确的是
ABD
(填字母)。A. 人工合成淀粉可减缓粮食危机
B. 人工合成淀粉可降低空气中$CO_2$含量
C. 淀粉的相对分子质量为$162g$
D. 人工合成淀粉比玉米通过光合作用合成效率高
答案:
(1)化学
(2)$\mathrm{H}{}_{2}\mathrm{O}{}_{2}$ 分子构成不同
(3)化学性质
(4)ABD 解析:
(1)二氧化碳到淀粉的转变过程,有新物质生成,所以是化学变化。
(2)由质量守恒定律,化学反应前后原子的种类及个数不变可知,$\mathrm{C}\mathrm{O}{}_{2}+3\mathrm{H}{}_{2}\xlongequal{一定条件}\mathrm{X}+\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}$,反应前有1个碳原子,2个氧原子,6个氢原子;$\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}$中有1个碳原子,4个氢原子,1个氧原子,由此说明一个X分子中含有氧原子1个,氢原子2个,所以X为$\mathrm{H}{}_{2}\mathrm{O}$;$\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}+\mathrm{O}{}_{2}\xlongequal{一定条件}\mathrm{Y}+\mathrm{H}\mathrm{C}\mathrm{H}\mathrm{O}$,反应前有1个碳原子,3个氧原子,4个氢原子;$\mathrm{H}\mathrm{C}\mathrm{H}\mathrm{O}$中有1个碳原子,2个氢原子,1个氧原子,由此说明一个Y分子中含有氧原子2个,氢原子2个,所以Y为$\mathrm{H}{}_{2}\mathrm{O}{}_{2}$;水和过氧化氢组成元素相同,但这两种物质化学性质不同的原因是分子构成不同。
(3)催化剂在反应前后质量和化学性质不变。
(4)人工合成淀粉可减缓粮食危机,A正确;人工合成淀粉可降低空气中$\mathrm{C}\mathrm{O}{}_{2}$含量,B正确;淀粉的相对分子质量无法确定,因为n值不确定且相对分子质量没有单位,C错误;人工合成淀粉比玉米通过光合作用合成效率高,因为人工途径的淀粉合成速率是玉米淀粉合成速率的8.5倍,D正确。
(1)化学
(2)$\mathrm{H}{}_{2}\mathrm{O}{}_{2}$ 分子构成不同
(3)化学性质
(4)ABD 解析:
(1)二氧化碳到淀粉的转变过程,有新物质生成,所以是化学变化。
(2)由质量守恒定律,化学反应前后原子的种类及个数不变可知,$\mathrm{C}\mathrm{O}{}_{2}+3\mathrm{H}{}_{2}\xlongequal{一定条件}\mathrm{X}+\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}$,反应前有1个碳原子,2个氧原子,6个氢原子;$\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}$中有1个碳原子,4个氢原子,1个氧原子,由此说明一个X分子中含有氧原子1个,氢原子2个,所以X为$\mathrm{H}{}_{2}\mathrm{O}$;$\mathrm{C}\mathrm{H}{}_{3}\mathrm{O}\mathrm{H}+\mathrm{O}{}_{2}\xlongequal{一定条件}\mathrm{Y}+\mathrm{H}\mathrm{C}\mathrm{H}\mathrm{O}$,反应前有1个碳原子,3个氧原子,4个氢原子;$\mathrm{H}\mathrm{C}\mathrm{H}\mathrm{O}$中有1个碳原子,2个氢原子,1个氧原子,由此说明一个Y分子中含有氧原子2个,氢原子2个,所以Y为$\mathrm{H}{}_{2}\mathrm{O}{}_{2}$;水和过氧化氢组成元素相同,但这两种物质化学性质不同的原因是分子构成不同。
(3)催化剂在反应前后质量和化学性质不变。
(4)人工合成淀粉可减缓粮食危机,A正确;人工合成淀粉可降低空气中$\mathrm{C}\mathrm{O}{}_{2}$含量,B正确;淀粉的相对分子质量无法确定,因为n值不确定且相对分子质量没有单位,C错误;人工合成淀粉比玉米通过光合作用合成效率高,因为人工途径的淀粉合成速率是玉米淀粉合成速率的8.5倍,D正确。
$14.$ 二氧化氯$(ClO_2)$是安全消毒剂$,$可由$NaClO_2$与$Cl_2$反应制得。
$(1)$配平化学方程式:$□NaClO_2+□Cl_2= □ClO_2+□NaCl。$
$(2)71gCl_2$完全反应$,$理论上最多生成$ClO_2$的质量为多少$?($写出计算过程$)$
$(1)$
$(2)$
$(1)$配平化学方程式:$□NaClO_2+□Cl_2= □ClO_2+□NaCl。$
$(2)71gCl_2$完全反应$,$理论上最多生成$ClO_2$的质量为多少$?($写出计算过程$)$
$(1)$
2 1 2 2
$(2)$
解:设理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为x。$2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+\mathrm{C}\mathrm{l}{}_{2}\xlongequal{}2\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}$71 135 71g x $\dfrac{71}{135}=\dfrac{71\mathrm{g}}{x}$$x = 135\mathrm{g}$
答:理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为135g。
答:理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为135g。
答案:
(1)2 1 2 2
(2)解:设理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为x。$2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+\mathrm{C}\mathrm{l}{}_{2}\xlongequal{}2\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}$71 135 71g x $\dfrac{71}{135}=\dfrac{71\mathrm{g}}{x}$$x = 135\mathrm{g}$答:理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为135g。
(1)2 1 2 2
(2)解:设理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为x。$2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+\mathrm{C}\mathrm{l}{}_{2}\xlongequal{}2\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}+2\mathrm{N}\mathrm{a}\mathrm{C}\mathrm{l}$71 135 71g x $\dfrac{71}{135}=\dfrac{71\mathrm{g}}{x}$$x = 135\mathrm{g}$答:理论上最多生成$\mathrm{C}\mathrm{l}\mathrm{O}{}_{2}$的质量为135g。
15. 甲、乙两组同学设计了如下实验来验证质量守恒定律。
(1)甲同学对教材实验进行改进,装置如图所示,实验前天平指针均指向分度盘中央。已知:氢氧化钠溶液可吸收$CO_2$生成碳酸钠溶液。


实验B的化学方程式为_________,若反应前镁条和氧气的质量相等,氧气和氧化镁的质量随反应时间的变化如图所示,请在图中补全镁的质量变化图。

(2)乙组同学研究了某物质W的组成。一定条件下,测得密闭容器内反应前后各物质的质量如图所示:

其中,x= _________,W中各元素的质量比为_________(用元素符号说明顺序,结果为最简整数比)。
(1)甲同学对教材实验进行改进,装置如图所示,实验前天平指针均指向分度盘中央。已知:氢氧化钠溶液可吸收$CO_2$生成碳酸钠溶液。


实验B的化学方程式为_________,若反应前镁条和氧气的质量相等,氧气和氧化镁的质量随反应时间的变化如图所示,请在图中补全镁的质量变化图。

(2)乙组同学研究了某物质W的组成。一定条件下,测得密闭容器内反应前后各物质的质量如图所示:

其中,x= _________,W中各元素的质量比为_________(用元素符号说明顺序,结果为最简整数比)。
答案:
(1)有气泡冒出,气球变大 气球变小,恢复原状 $2\mathrm{M}\mathrm{g}+\mathrm{O}{}_{2}\xlongequal{点燃}2\mathrm{M}\mathrm{g}\mathrm{O}$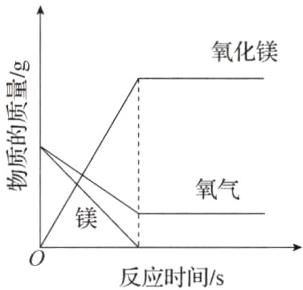
(2)52 C、H、O三种元素的质量比为12∶3∶8解析:
(1)稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,挤压左侧胶头滴管,滴入足量稀盐酸,生成气体,气球膨胀。步骤Ⅰ反应停止后,挤压右侧胶头滴管,滴入过量浓氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,压强变小,气球恢复原状。实验B的反应是镁在氧气中燃烧生成氧化镁,则反应的化学方程式为$2\mathrm{M}\mathrm{g}+\mathrm{O}{}_{2}\xlongequal{点燃}2\mathrm{M}\mathrm{g}\mathrm{O}$。由图像可知,氧气有剩余,镁条反应完全,反应前镁条和氧气的质量相等,镁的质量变化图如下。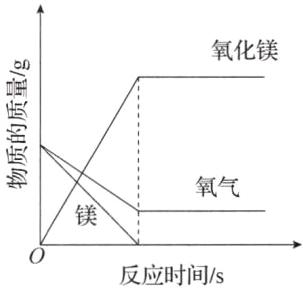
(2)由质量守恒定律可知,参加反应的反应物的总质量等于生成物的总质量,化学反应前后元素的质量和种类不变,则$8\mathrm{g}+5\mathrm{g}+64\mathrm{g}+23\mathrm{g}=32\mathrm{g}+16\mathrm{g}+x\mathrm{g}$,$x = 52$。四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是$23\mathrm{g}+(64\mathrm{g}-16\mathrm{g})=71\mathrm{g}$,生成物水的质量增加了$32\mathrm{g}-5\mathrm{g}=27\mathrm{g}$,生成物$\mathrm{C}\mathrm{O}{}_{2}$的质量增加了$52\mathrm{g}-8\mathrm{g}=44\mathrm{g}$;此反应的表达式可表示为$\mathrm{W}+\mathrm{O}{}_{2}\xrightarrow{一定条件}\mathrm{C}\mathrm{O}{}_{2}+\mathrm{H}{}_{2}\mathrm{O}$,反应后生成物中有碳元素、氢元素,则W中一定含有碳元素和氢元素,可能含有氧元素。二氧化碳中碳元素的质量为$44\mathrm{g}× (\dfrac{12}{44}× 100\%)=12\mathrm{g}$,氧元素的质量为$44\mathrm{g}× (\dfrac{32}{44}× 100\%)=32\mathrm{g}$,水中氢元素的质量为$27\mathrm{g}× (\dfrac{2}{18}× 100\%)=3\mathrm{g}$,氧元素的质量为$27\mathrm{g}× (\dfrac{16}{18}× 100\%)=24\mathrm{g}$。则W中含碳元素的质量为12g,含氢元素的质量为3g,含氧元素的质量为$23\mathrm{g}-12\mathrm{g}-3\mathrm{g}=8\mathrm{g}$,W中C、H、O三种元素的质量比为12∶3∶8。
(1)有气泡冒出,气球变大 气球变小,恢复原状 $2\mathrm{M}\mathrm{g}+\mathrm{O}{}_{2}\xlongequal{点燃}2\mathrm{M}\mathrm{g}\mathrm{O}$

(2)52 C、H、O三种元素的质量比为12∶3∶8解析:
(1)稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,挤压左侧胶头滴管,滴入足量稀盐酸,生成气体,气球膨胀。步骤Ⅰ反应停止后,挤压右侧胶头滴管,滴入过量浓氢氧化钠溶液,氢氧化钠与二氧化碳反应生成碳酸钠和水,压强变小,气球恢复原状。实验B的反应是镁在氧气中燃烧生成氧化镁,则反应的化学方程式为$2\mathrm{M}\mathrm{g}+\mathrm{O}{}_{2}\xlongequal{点燃}2\mathrm{M}\mathrm{g}\mathrm{O}$。由图像可知,氧气有剩余,镁条反应完全,反应前镁条和氧气的质量相等,镁的质量变化图如下。

(2)由质量守恒定律可知,参加反应的反应物的总质量等于生成物的总质量,化学反应前后元素的质量和种类不变,则$8\mathrm{g}+5\mathrm{g}+64\mathrm{g}+23\mathrm{g}=32\mathrm{g}+16\mathrm{g}+x\mathrm{g}$,$x = 52$。四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是$23\mathrm{g}+(64\mathrm{g}-16\mathrm{g})=71\mathrm{g}$,生成物水的质量增加了$32\mathrm{g}-5\mathrm{g}=27\mathrm{g}$,生成物$\mathrm{C}\mathrm{O}{}_{2}$的质量增加了$52\mathrm{g}-8\mathrm{g}=44\mathrm{g}$;此反应的表达式可表示为$\mathrm{W}+\mathrm{O}{}_{2}\xrightarrow{一定条件}\mathrm{C}\mathrm{O}{}_{2}+\mathrm{H}{}_{2}\mathrm{O}$,反应后生成物中有碳元素、氢元素,则W中一定含有碳元素和氢元素,可能含有氧元素。二氧化碳中碳元素的质量为$44\mathrm{g}× (\dfrac{12}{44}× 100\%)=12\mathrm{g}$,氧元素的质量为$44\mathrm{g}× (\dfrac{32}{44}× 100\%)=32\mathrm{g}$,水中氢元素的质量为$27\mathrm{g}× (\dfrac{2}{18}× 100\%)=3\mathrm{g}$,氧元素的质量为$27\mathrm{g}× (\dfrac{16}{18}× 100\%)=24\mathrm{g}$。则W中含碳元素的质量为12g,含氢元素的质量为3g,含氧元素的质量为$23\mathrm{g}-12\mathrm{g}-3\mathrm{g}=8\mathrm{g}$,W中C、H、O三种元素的质量比为12∶3∶8。
查看更多完整答案,请扫码查看


