2025年天利38套常考基础题高中化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年天利38套常考基础题高中化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第3页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
9.(2023·6月浙江卷)下列反应的离子方程式正确的是 ( )
A.碘化亚铁溶液与等物质的量的氯气:2Fe²⁺+2I⁻+2Cl₂==2Fe³⁺+I₂+4Cl⁻
B.向次氯酸钙溶液通入足量二氧化碳:ClO⁻+CO₂+H₂O==HClO+HCO₃⁻
C.铜与稀硝酸:Cu+4H⁺+2NO₃⁻==Cu²⁺+2NO₂↑+2H₂O
D.向硫化钠溶液通入足量二氧化硫:S²⁻+2SO₂+2H₂O==H₂S+2HSO₃⁻
A.碘化亚铁溶液与等物质的量的氯气:2Fe²⁺+2I⁻+2Cl₂==2Fe³⁺+I₂+4Cl⁻
B.向次氯酸钙溶液通入足量二氧化碳:ClO⁻+CO₂+H₂O==HClO+HCO₃⁻
C.铜与稀硝酸:Cu+4H⁺+2NO₃⁻==Cu²⁺+2NO₂↑+2H₂O
D.向硫化钠溶液通入足量二氧化硫:S²⁻+2SO₂+2H₂O==H₂S+2HSO₃⁻
答案:
B 离子方程式正误判断
[解析]还原性:I⁻>Fe²⁺,碘化亚铁溶液与等物质的量的氯气反应的离子方程式为2I⁻ + Cl₂ = I₂ + 2Cl⁻,A错误;向次氯酸钙溶液中通入足量二氧化碳,反应生成碳酸氢钙和次氯酸,反应的离子方程式为CO₂ + ClO⁻ + H₂O = HClO + HCO₃⁻,B正确;铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu + 8H⁺ + 2NO₃⁻ = 3Cu²⁺ + 2NO↑ + 4H₂O,C错误;向硫化钠溶液中通入足量二氧化硫,反应的离子方程式为2S²⁻ + 5SO₂ + 2H₂O = 3S↓ + 4HSO₃⁻,D错误。
[解析]还原性:I⁻>Fe²⁺,碘化亚铁溶液与等物质的量的氯气反应的离子方程式为2I⁻ + Cl₂ = I₂ + 2Cl⁻,A错误;向次氯酸钙溶液中通入足量二氧化碳,反应生成碳酸氢钙和次氯酸,反应的离子方程式为CO₂ + ClO⁻ + H₂O = HClO + HCO₃⁻,B正确;铜与稀硝酸反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu + 8H⁺ + 2NO₃⁻ = 3Cu²⁺ + 2NO↑ + 4H₂O,C错误;向硫化钠溶液中通入足量二氧化硫,反应的离子方程式为2S²⁻ + 5SO₂ + 2H₂O = 3S↓ + 4HSO₃⁻,D错误。
10.下列反应的离子方程式正确的是 ( )
A.饱和Na₂CO₃溶液浸泡CaSO₄水垢:CO₃²⁻+Ca²⁺==CaCO₃↓
B.Na₂S₂O₃溶液中通入少量氯气:S₂O₃²⁻+4Cl₂+5H₂O==2SO₄²⁻+8Cl⁻+10H⁺
C.丙烯醛与足量溴水反应:CH₂=CHCHO + 2Br₂ + H₂O→CH₂BrCHBrCOOH + 2H⁺+2Br⁻
D.水杨酸与过量碳酸钠溶液反应:CO₃²⁻+ →
→  +CO₂↑+H₂O
+CO₂↑+H₂O
A.饱和Na₂CO₃溶液浸泡CaSO₄水垢:CO₃²⁻+Ca²⁺==CaCO₃↓
B.Na₂S₂O₃溶液中通入少量氯气:S₂O₃²⁻+4Cl₂+5H₂O==2SO₄²⁻+8Cl⁻+10H⁺
C.丙烯醛与足量溴水反应:CH₂=CHCHO + 2Br₂ + H₂O→CH₂BrCHBrCOOH + 2H⁺+2Br⁻
D.水杨酸与过量碳酸钠溶液反应:CO₃²⁻+
 →
→  +CO₂↑+H₂O
+CO₂↑+H₂O
答案:
C 离子方程式的正误判断
[解析]用饱和Na₂CO₃溶液浸泡CaSO₄水垢,将CaSO₄沉淀转化为更难溶的CaCO₃,反应的离子方程式为CO₃²⁻ + CaSO₄⇌CaCO₃ + SO₄²⁻,A项错误;向Na₂S₂O₃溶液中通入少量氯气,S₂O₃²⁻被氧化成SO₄²⁻,反应生成的H⁺与S₂O₃²⁻发生反应,反应的离子方程式为6S₂O₃²⁻ + 4Cl₂ = 2SO₄²⁻ + 5S↓ + 5SO₂↑ + 8Cl⁻,B项错误;丙烯醛的结构简式为CH₂=CHCHO,分子中含有碳碳双键和醛基,其中碳碳双键可与溴水发生加成反应,醛基可被溴水氧化为羧基,反应的离子方程式为CH₂ = CHCHO + 2Br₂ + H₂O→CH₂BrCHBrCOOH + 2H⁺ + 2Br⁻,C项正确;由于酸性强弱顺序为羧基>H₂CO₃>酚羟基>HCO₃⁻,所以水杨酸与过量碳酸钠溶液反应生成HCO₃⁻和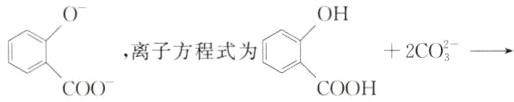
 ,离子方程式为 + 2CO₃²⁻→ + 2HCO₃⁻,D项错误。
,离子方程式为 + 2CO₃²⁻→ + 2HCO₃⁻,D项错误。
C 离子方程式的正误判断
[解析]用饱和Na₂CO₃溶液浸泡CaSO₄水垢,将CaSO₄沉淀转化为更难溶的CaCO₃,反应的离子方程式为CO₃²⁻ + CaSO₄⇌CaCO₃ + SO₄²⁻,A项错误;向Na₂S₂O₃溶液中通入少量氯气,S₂O₃²⁻被氧化成SO₄²⁻,反应生成的H⁺与S₂O₃²⁻发生反应,反应的离子方程式为6S₂O₃²⁻ + 4Cl₂ = 2SO₄²⁻ + 5S↓ + 5SO₂↑ + 8Cl⁻,B项错误;丙烯醛的结构简式为CH₂=CHCHO,分子中含有碳碳双键和醛基,其中碳碳双键可与溴水发生加成反应,醛基可被溴水氧化为羧基,反应的离子方程式为CH₂ = CHCHO + 2Br₂ + H₂O→CH₂BrCHBrCOOH + 2H⁺ + 2Br⁻,C项正确;由于酸性强弱顺序为羧基>H₂CO₃>酚羟基>HCO₃⁻,所以水杨酸与过量碳酸钠溶液反应生成HCO₃⁻和

 ,离子方程式为 + 2CO₃²⁻→ + 2HCO₃⁻,D项错误。
,离子方程式为 + 2CO₃²⁻→ + 2HCO₃⁻,D项错误。 11.(2023·湖南卷)下列有关电极方程式或离子方程式错误的是 ( )
A.碱性锌锰电池的正极反应:MnO₂+H₂O+e⁻=MnO(OH)+OH⁻
B.铅酸蓄电池充电时的阳极反应:Pb²⁺+2H₂O - 2e⁻=PbO₂+4H⁺
C.K₃[Fe(CN)₆]溶液滴入FeCl₂溶液中:K⁺+Fe²⁺+[Fe(CN)₆]³⁻=KFe[Fe(CN)₆]↓
D.TiCl₄加入水中:TiCl₄+(x+2)H₂O=TiO₂·xH₂O↓+4H⁺+4Cl⁻
A.碱性锌锰电池的正极反应:MnO₂+H₂O+e⁻=MnO(OH)+OH⁻
B.铅酸蓄电池充电时的阳极反应:Pb²⁺+2H₂O - 2e⁻=PbO₂+4H⁺
C.K₃[Fe(CN)₆]溶液滴入FeCl₂溶液中:K⁺+Fe²⁺+[Fe(CN)₆]³⁻=KFe[Fe(CN)₆]↓
D.TiCl₄加入水中:TiCl₄+(x+2)H₂O=TiO₂·xH₂O↓+4H⁺+4Cl⁻
答案:
B 电极方程式和离子方程式的书写 碱性锌锰电池中MnO₂作正极,电极反应式为MnO₂ + H₂O + e⁻ = MnO(OH) + OH⁻,A项正确;铅酸蓄电池充电时阳极反应式为PbSO₄ + 2H₂O - 2e⁻ = PbO₂ + 4H⁺ + SO₄²⁻,B项错误;K₃[Fe(CN)₆]溶液滴入FeCl₂中产生蓝色沉淀KFe[Fe(CN)₆],离子方程式为K⁺ + Fe²⁺ + [Fe(CN)₆]³⁻ = KFe[Fe(CN)₆]↓,C项正确;将TiCl₄加入水中产生TiO₂·xH₂O沉淀,离子方程式为TiCl₄ + (x + 2)H₂O = TiO₂·xH₂O↓ + 4H⁺ + 4Cl⁻,D项正确。
12.宏观辨识与微观探析是化学学科核心素养之一。下列方程式能正确解释相应事实的是 ( )
A.用Cu作电极电解饱和食盐水:2Cl⁻+2H₂O 电解=Cl₂↑+H₂↑+2OH⁻
B.向饱和Na₂CO₃溶液中通入CO₂气体:CO₂+H₂O+CO₃²⁻==2HCO₃⁻
C.向碘化亚铁溶液中滴加少量稀硝酸:2NO₃⁻+3Fe²⁺+4H⁺==3Fe³⁺+2NO↑+2H₂O
D.向AlCl₃溶液中滴入氨水产生白色沉淀:Al³⁺+3NH₃·H₂O==Al(OH)₃↓+3NH₄⁺
A.用Cu作电极电解饱和食盐水:2Cl⁻+2H₂O 电解=Cl₂↑+H₂↑+2OH⁻
B.向饱和Na₂CO₃溶液中通入CO₂气体:CO₂+H₂O+CO₃²⁻==2HCO₃⁻
C.向碘化亚铁溶液中滴加少量稀硝酸:2NO₃⁻+3Fe²⁺+4H⁺==3Fe³⁺+2NO↑+2H₂O
D.向AlCl₃溶液中滴入氨水产生白色沉淀:Al³⁺+3NH₃·H₂O==Al(OH)₃↓+3NH₄⁺
答案:
D 离子方程式书写
[解析]用Cu作电极电解饱和食盐水,电极总反应式为Cu + 2H₂O通电̲H₂↑ + Cu(OH)₂↓,A错误;向饱和Na₂CO₃溶液中通入CO₂气体生成碳酸氢钠晶体,反应的离子方程式为2Na⁺ + CO₂ + H₂O + CO₃²⁻ = 2NaHCO₃↓,B错误;还原性:I⁻>Fe²⁺,故向碘化亚铁溶液中滴加少量稀硝酸,反应的离子方程式为2NO₃⁻ + 6I⁻ + 8H⁺ = 3I₂ + 2NO↑ + 4H₂O,C错误;向氯化铝溶液中滴入氨水,有氢氧化铝白色沉淀生成,因氨水碱性较弱,当加入过量氨水时,沉淀不溶解,其离子方程式为Al³⁺ + 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄⁺,D正确。
[解析]用Cu作电极电解饱和食盐水,电极总反应式为Cu + 2H₂O通电̲H₂↑ + Cu(OH)₂↓,A错误;向饱和Na₂CO₃溶液中通入CO₂气体生成碳酸氢钠晶体,反应的离子方程式为2Na⁺ + CO₂ + H₂O + CO₃²⁻ = 2NaHCO₃↓,B错误;还原性:I⁻>Fe²⁺,故向碘化亚铁溶液中滴加少量稀硝酸,反应的离子方程式为2NO₃⁻ + 6I⁻ + 8H⁺ = 3I₂ + 2NO↑ + 4H₂O,C错误;向氯化铝溶液中滴入氨水,有氢氧化铝白色沉淀生成,因氨水碱性较弱,当加入过量氨水时,沉淀不溶解,其离子方程式为Al³⁺ + 3NH₃·H₂O = Al(OH)₃↓ + 3NH₄⁺,D正确。
二、非选择题(本题共1小题)
13.现有无色透明溶液,只含有下列离子中的若干种,每种离子的个数相等:Na⁺、NH₄⁺、Cl⁻、Fe³⁺、
Ba²⁺、CO₃²⁻、SO₄²⁻。现各取三份100mL溶液进行实验。
实验1:第一份加入足量AgNO₃溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出,查资料知有NH₄⁺存在;
实验3:第三份加入足量BaCl₂溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定有Cl⁻存在? (填"能"或“否”),理由:______________________。
(2)实验3中沉淀的化学式为__________,该沉淀溶于盐酸的离子方程式为____________________。
(3)综合上述实验,能否确定有Na⁺存在?__________(填“能"或“否”)。请说明理由:________
13.现有无色透明溶液,只含有下列离子中的若干种,每种离子的个数相等:Na⁺、NH₄⁺、Cl⁻、Fe³⁺、
Ba²⁺、CO₃²⁻、SO₄²⁻。现各取三份100mL溶液进行实验。
实验1:第一份加入足量AgNO₃溶液有白色沉淀产生;
实验2:第二份加入足量NaOH溶液加热有气体放出,查资料知有NH₄⁺存在;
实验3:第三份加入足量BaCl₂溶液后,有沉淀生成,加入足量盐酸后沉淀全部溶解。
(1)由实验1能否确定有Cl⁻存在? (填"能"或“否”),理由:______________________。
(2)实验3中沉淀的化学式为__________,该沉淀溶于盐酸的离子方程式为____________________。
(3)综合上述实验,能否确定有Na⁺存在?__________(填“能"或“否”)。请说明理由:________
答案:
(1)否 加入足量AgNO₃溶液有白色沉淀产生,生成的沉淀可能为AgCl、Ag₂CO₃或Ag₂SO₄,溶液中不一定含有Cl⁻
(2)BaCO₃ BaCO₃ + 2H⁺ = Ba²⁺ + CO₂↑ + H₂O
(3)能 因为该溶液中每种离子的个数相等,已判断含有NH₄⁺、CO₃²⁻,根据溶液呈电中性可以确定还含有Na⁺
离子的检验
[解析]
(1)Ag⁺与Cl⁻、CO₃²⁻、SO₄²⁻均能生成白色沉淀,因此由实验1不能确定有Cl⁻存在。
(2)加入BaCl₂溶液后有沉淀生成且此沉淀在盐酸中能全部溶解,说明此沉淀为BaCO₃,该沉淀溶于盐酸生成BaCl₂、CO₂和H₂O。
(3)综合三个实验以及溶液无色透明的特点,可以判断出该溶液中含有NH₄⁺、CO₃²⁻,不含Ba²⁺、SO₄²⁻、Fe³⁺,根据溶液呈电中性且每种离子的个数相等,可以确定还有Na⁺存在。
(1)否 加入足量AgNO₃溶液有白色沉淀产生,生成的沉淀可能为AgCl、Ag₂CO₃或Ag₂SO₄,溶液中不一定含有Cl⁻
(2)BaCO₃ BaCO₃ + 2H⁺ = Ba²⁺ + CO₂↑ + H₂O
(3)能 因为该溶液中每种离子的个数相等,已判断含有NH₄⁺、CO₃²⁻,根据溶液呈电中性可以确定还含有Na⁺
离子的检验
[解析]
(1)Ag⁺与Cl⁻、CO₃²⁻、SO₄²⁻均能生成白色沉淀,因此由实验1不能确定有Cl⁻存在。
(2)加入BaCl₂溶液后有沉淀生成且此沉淀在盐酸中能全部溶解,说明此沉淀为BaCO₃,该沉淀溶于盐酸生成BaCl₂、CO₂和H₂O。
(3)综合三个实验以及溶液无色透明的特点,可以判断出该溶液中含有NH₄⁺、CO₃²⁻,不含Ba²⁺、SO₄²⁻、Fe³⁺,根据溶液呈电中性且每种离子的个数相等,可以确定还有Na⁺存在。
查看更多完整答案,请扫码查看


