【题目】明矾【化学式KAl(SO4)2·12H2O,相对分子质量474】可作炸油条的膨松剂。
(1)明矾含有___________种元素;明矾中硫、氧元素的质量比为_______________。
(2)铝元素属于人体的_________(填“有害”或“非必需”)元素。研究表明,成人日摄入铝量应控制在4 mg以下。若每1000 g调和好的炸油条面中含明矾1.58 g,每根油条用面50 g,则食用2根油条所摄入铝的质量为____mg,超过了成人的日摄入控制量。
参考答案:
【答案】 5 1:5 非必需 9
【解析】(1)根据明矾的化学式解答;(2)根据铝属于人体非必需元素及相关计算解答。(1)明矾含有K、Al、S、O、H共5种元素;明矾中硫、氧元素的质量比为(32×2):(16×20)=1:5;(2)铝元素属于人体的非必需元素;食用2根油条所摄入铝的质量为[1.58g×1000÷(1000g÷50g)×2]×![]() =9mg,超过了成人的日摄入控制量。
=9mg,超过了成人的日摄入控制量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室有一固体混合物,可能含有Fe2O3、Cu、C、NH4HCO3、NH4Cl、(NH4)2SO4等物质中的几种,设计以下流程进行检验:(已知:Fe2(SO4)3+Cu === CuSO4+2FeSO4)。
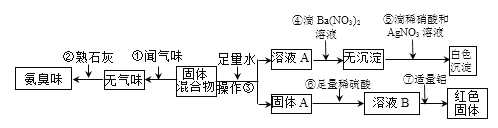
(1)由操作①推知,固体混合物中一定没有_______________________(填名称)。(2)操作③的名称是_________,所用到的玻璃仪器有玻璃棒、漏斗和__________。(3)由操作②④⑤推知,操作②发生反应的化学方程式为___________。
(4)由操作⑥⑦推知,固体A含有的物质是_______________(填化学式);操作⑦反应生成红色固体的化学方程式为___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据图示回答相关问题。
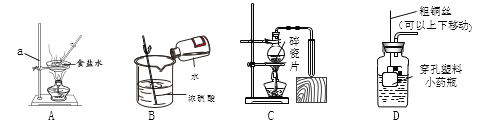
(1)仪器a的名称是__________。进行A操作时,通常在蒸发皿内出现_________时即停止加热,利用余热蒸干。
(2)图A~C的装置和操作中,没有错误的是_____(填序号)。请选择其中一个有错误的图示,写出改正方法:________。
(3)用双氧水和二氧化锰混合制取氧气的化学方程式为_____________________;若要控制该反应的发生和停止,选用D作发生装置达不到目的,原因是____________。
(4)如图为制备CO并还原Fe3O4 的“微型”实验装置(夹持仪器等已略去)。已知甲酸的分解反应为:HCOOH
 H2O+CO↑。
H2O+CO↑。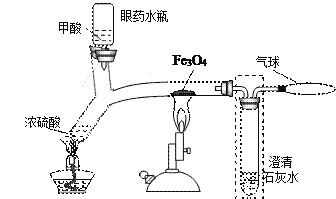
①装置中气球的作用是___________;
②CO与Fe3O4反应的化学方程式为_____________;
③该装置的优点是(写一条)______________________________;
④请把图中虚线框内的导管补画完整_________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】当把燃着的小蜡烛放入一个集气瓶中并塞紧胶塞时,蜡烛一会儿就熄灭了。那么,蜡烛为什么会熄灭呢?某化学兴趣小组进行了如下探究,请你填答相关空格。
【提出猜想】猜想Ⅰ:蜡烛燃烧把集气瓶内的氧气耗尽,导致蜡烛熄灭。
猜想Ⅱ:蜡烛燃烧随集气瓶内氧气含量降低而变弱,放出的热量减少,使温度降至蜡烛的____________________以下,导致蜡烛熄灭。
猜想Ⅲ:蜡烛燃烧产生的二氧化碳能灭火,导致蜡烛熄灭。
【进行实验】小组设计如下图所示的实验装置,并进行实验来验证猜想。
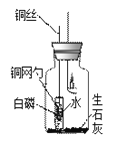
实验操作
实验现象
点燃蜡烛并连同胶塞上的其它仪器药品一起放入集气瓶中,塞紧胶塞
蜡烛火焰逐渐变微弱最终____
蜡烛熄灭并静置冷却后,将铜丝上提,使盛白磷的铜网勺高于试管口,试管倒下,水流出。
一会儿后,白磷着火燃烧,有大量____产生
【分析及结论】
(1)蜡烛熄灭前,要让白磷浸没在小试管所盛的水中,目的是_________。
(2)集气瓶中装入一些生石灰的设计目的,是让它发生反应提高瓶内的_____,该反应的化学方程式为__________。
(3)瓶内的白磷能燃烧,证明猜想____和____不能成立。我们根据成立的猜想认为,应该把“燃烧需要氧气”这一燃烧发生的条件补充完善为“____________”。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验室用含硫酸铜和盐酸的混合液与混入了锌粉的铜粉(以下简称铜锌粉)反应来测定混合液中盐酸的质量分数和铜锌粉中锌的含量。操作如下:取200 g混合液于实验容器中,分五次加入铜锌粉,边加边搅拌,以保证盐酸和硫酸铜同时与锌充分反应。实验测得的相关数据如下表:
第一次
第二次
第三次
第四次
第五次
加入铜锌粉的累计质量/ g
9
18
27
36
40
产生氢气的累计质量/ g
0.1
0.2
m
0.4
0.4
容器中剩余固体的质量/ g
5.71
11.42
17.13
22.84
26.84
(1)表中m的值为_____________。
(2)第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为_____________。
(3)计算原混合液中盐酸的质量分数是多少_____________?(写出计算过程,结果精确到0.1%)
(4)通过计算可知,每9 g铜锌粉中含有_______________g锌粉。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组对H2O2分解的各种催化剂的催化效果进行定量对比探究。小组人员选用海藻酸钠(海藻酸钠是一种天然高分子物质,在本实验中性质稳定)作为催化剂支架,制备负载不同催化剂的海藻酸钠微球,利用数字化手持技术展开探究。
【实验过程】 取负载各种催化剂的海藻酸钠微球各30粒分别放入4个锥形瓶中,连接压力传感器(如图1所示)。用注射器分别向每个锥形瓶中注入20 mL浓度为5% H2O2溶液,溶液全部注入瞬间立即采集200 s内压强数据,最后用软件绘制实验图形如图2所示(肝脏研磨液富含过氧化氢酶,酶主要成分为蛋白质)。
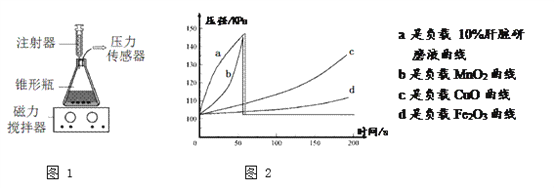
【实验分析】
⑴ 写出b瓶中反应的化学方程式____。上述四种中催化效果最差的物质是___。
⑵ a、b、c瓶中的海藻酸钠微球都浮了起来,主要原因是_______。
⑶ a 、b瓶在60秒左右时压强突然恢复到常压,最可能原因是_____。
⑷ 前50秒内,b、c、d瓶中反应速率越来越快,可能原因是_____,实验中发现a瓶中催化剂的性能随反应进行越来越弱,可能原因是:__________。
⑸ 若实验中过氧化氢溶液完全反应,则本实验理论上每瓶能得到氧气的质量为多少__________?(5%的过氧化氢溶液密度约为1g/mL,最终结果精确到小数点后两位)
-
科目: 来源: 题型:
查看答案和解析>>【题目】某科研小组对废弃辉铜矿(主要含有 Cu2S、ZnO 及一些不溶性杂质)进行物质提纯以实现废物综合利用。部分实验流程如下:
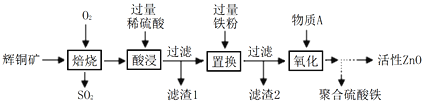
请根据上述实验流程回答下列问题:
⑴ “焙烧”中生成CuO和SO2,该气体直接排放会使雨水pH小于___________,形成酸雨。
⑵ “酸浸”时发生的反应类型是________________________。
⑶ “置换”时反应的化学方程式为__________(写出一个即可)。滤渣2的成分为_____(填化学式)。
⑷ “氧化”时高锰酸钾溶液和双氧水都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用____较合适。
⑸ 聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则b∶a =_____________。
相关试题

