【题目】某科研小组对废弃辉铜矿(主要含有 Cu2S、ZnO 及一些不溶性杂质)进行物质提纯以实现废物综合利用。部分实验流程如下:
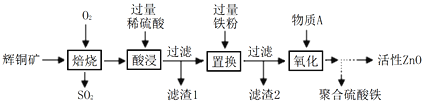
请根据上述实验流程回答下列问题:
⑴ “焙烧”中生成CuO和SO2,该气体直接排放会使雨水pH小于___________,形成酸雨。
⑵ “酸浸”时发生的反应类型是________________________。
⑶ “置换”时反应的化学方程式为__________(写出一个即可)。滤渣2的成分为_____(填化学式)。
⑷ “氧化”时高锰酸钾溶液和双氧水都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用____较合适。
⑸ 聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,则b∶a =_____________。
参考答案:
【答案】 5.6 复分解反应 Fe+H2SO4 ==FeSO4 +H2↑或Fe+CuSO4==Cu+FeSO4 Fe、Cu 双氧水 1:2(或0.5)
【解析】对废弃辉铜矿进行物质提纯以实现废物综合利用。⑴ “焙烧”中生成CuO和SO2,该气体直接排放会使雨水pH小于5.6,形成酸雨,二氧化硫与水反应生成亚硫酸,亚硫酸溶液呈酸性。⑵ “酸浸”时发生的反应类型是复分解反应,氧化铜与硫酸反应生成硫酸铜和水。⑶ “置换”时反应的化学方程式为Fe+H2SO4 =FeSO4 +H2↑或Fe+CuSO4=Cu+FeSO4。滤渣2的成分为Fe、Cu,铁比铜活泼,铁与硫酸铜溶液反应置换出铜,铁粉过量。⑷ “氧化”时高锰酸钾溶液和双氧水都能将Fe2+氧化为Fe3+,从绿色化学角度考虑物质A选用双氧水,双氧水产物是水,对环境没有污染。⑸ 聚合硫酸铁常用于净水,其化学式可表示为[Fea(OH)b(SO4)c]n。实验测得某聚合硫酸铁中铁离子与硫酸根离子的质量比为7∶15,56×a∶98×c=7∶15,a∶c=4∶7,根据化合物中化合价代数和为零原则,3a-b-2c=0,则b∶a = 1:2。
点睛∶二氧化硫与水反应生成亚硫酸,亚硫酸溶液呈酸性,二氧化硫是造成酸雨的主要气体之一。化合物中化合价代数和为零。
-
科目: 来源: 题型:
查看答案和解析>>【题目】明矾【化学式KAl(SO4)2·12H2O,相对分子质量474】可作炸油条的膨松剂。
(1)明矾含有___________种元素;明矾中硫、氧元素的质量比为_______________。
(2)铝元素属于人体的_________(填“有害”或“非必需”)元素。研究表明,成人日摄入铝量应控制在4 mg以下。若每1000 g调和好的炸油条面中含明矾1.58 g,每根油条用面50 g,则食用2根油条所摄入铝的质量为____mg,超过了成人的日摄入控制量。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某实验室用含硫酸铜和盐酸的混合液与混入了锌粉的铜粉(以下简称铜锌粉)反应来测定混合液中盐酸的质量分数和铜锌粉中锌的含量。操作如下:取200 g混合液于实验容器中,分五次加入铜锌粉,边加边搅拌,以保证盐酸和硫酸铜同时与锌充分反应。实验测得的相关数据如下表:
第一次
第二次
第三次
第四次
第五次
加入铜锌粉的累计质量/ g
9
18
27
36
40
产生氢气的累计质量/ g
0.1
0.2
m
0.4
0.4
容器中剩余固体的质量/ g
5.71
11.42
17.13
22.84
26.84
(1)表中m的值为_____________。
(2)第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为_____________。
(3)计算原混合液中盐酸的质量分数是多少_____________?(写出计算过程,结果精确到0.1%)
(4)通过计算可知,每9 g铜锌粉中含有_______________g锌粉。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某研究小组对H2O2分解的各种催化剂的催化效果进行定量对比探究。小组人员选用海藻酸钠(海藻酸钠是一种天然高分子物质,在本实验中性质稳定)作为催化剂支架,制备负载不同催化剂的海藻酸钠微球,利用数字化手持技术展开探究。
【实验过程】 取负载各种催化剂的海藻酸钠微球各30粒分别放入4个锥形瓶中,连接压力传感器(如图1所示)。用注射器分别向每个锥形瓶中注入20 mL浓度为5% H2O2溶液,溶液全部注入瞬间立即采集200 s内压强数据,最后用软件绘制实验图形如图2所示(肝脏研磨液富含过氧化氢酶,酶主要成分为蛋白质)。
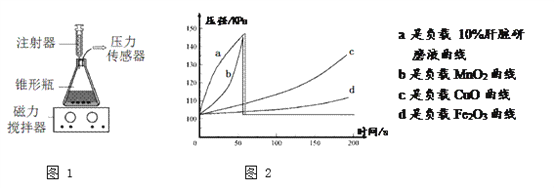
【实验分析】
⑴ 写出b瓶中反应的化学方程式____。上述四种中催化效果最差的物质是___。
⑵ a、b、c瓶中的海藻酸钠微球都浮了起来,主要原因是_______。
⑶ a 、b瓶在60秒左右时压强突然恢复到常压,最可能原因是_____。
⑷ 前50秒内,b、c、d瓶中反应速率越来越快,可能原因是_____,实验中发现a瓶中催化剂的性能随反应进行越来越弱,可能原因是:__________。
⑸ 若实验中过氧化氢溶液完全反应,则本实验理论上每瓶能得到氧气的质量为多少__________?(5%的过氧化氢溶液密度约为1g/mL,最终结果精确到小数点后两位)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是某食盐包装上的部分说明。食盐中加入碘酸钾的目的是补充微量元素___________。

【提出问题】为什么在汤、菜即将煮好时再加入碘盐才能确保碘效?
【查阅资料】碘酸钾的化学式是KIO3,是一种白色粉末,熔点560℃。采用热重分析仪对碘酸钾加热过程展开研究,混合物中碘酸钾的的质量分数(纵坐标)随温度(横坐标)变化的曲线如图10所示。
【猜想假设1】KIO3与KClO3性质类似,受热分解产生O2。
【实验探究1】研究小组进行如图11所示实验,宜选用装置___________进行。验证KIO3分解产生氧气的操作和现象为_________________________。
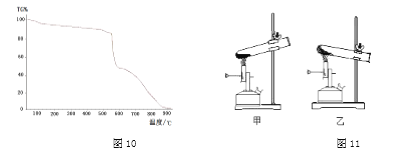
【得出结论1】KIO3受热同时生成碘化钾(KI),反应方程式为_____________________。
【提出新问题】为什么生成KI就会降低碘效?
【查阅资料2】KIO3在人体内转化为I-而被吸收。KI是白色固体,在空气中与O2、CO2、H2O中的两种或三种物质反应生成单质I2而泛黄变质。
【实验探究2】研究小组开展以下实验。
操 作
现 象
结 论
如下图所示,在燃烧匙中放入KI固体,然后分别放置在① ② ③号试管中,数日后观察现象。
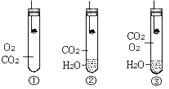
_________
KI固体在空气中与O2、CO2、H2O共同作用而变质导致碘效降低。
【反思提高】
⑴ 讨论后大家认为以上实验方案有所欠缺。甲同学做了补充实验:_____________,数日后观察无明显现象,证明以上结论正确。
⑵ 乙同学推测另一种产物是碳酸盐,请用实验加以证明:______________,证明推测正确。
【拓展应用】生活中鉴别真假加碘盐的方法是:取少量碘盐样品在干净的锅里高温爆炒2分钟,再加入部分未爆炒过的碘盐在碗中混合,加少量白醋,再把刚切好的土豆片浸泡其中,20分钟后若溶液变蓝,则是加碘盐。下列说法不正确的是(_________)
A.实验中土豆片不可用其它食品代替
B.直接将加碘盐放在土豆片上不能呈现蓝色
C.可能是酸性条件下KIO3和KI能反应生成I2
D.烹饪时加醋可能增大食盐中的碘流失
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是研究物质的科学。
⑴ C3H8O是重要的有机物,由______种元素组成,H与O的元素质量比为_____。
⑵ C3H8O也可用作燃料,在氧气中完全燃烧的方程式为:____________。
⑶ 下图装置可模拟植物光合作用,被称为“人工树叶”。
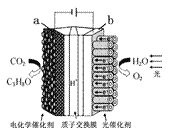
下列说法正确的是(_________)
A.该装置的外形肯定像树叶 B.装置将化学能转化为光能
C.反应生成物为C3H8O和O2 D.反应实现了无机物向有机物的转化
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学促进人类社会发展。
⑴ 可用Mg、Al等和稀硫酸反应制取氢气,反应类型属于__________反应;也可用Mg、Al和NaOH溶液组成化学电池,它可以将化学能转化为_________能。
⑵ Mg17Al12是一种新型储氢材料,一定条件下完全吸氢后转化为MgH2和Al,反应方程式为_____。
⑶ 科学家认为“氢能将成为未来的理想能源”,原因是(___________)
A.完全燃烧放出热量多 B.制取原料资源不受限制
C.燃烧产物不污染环境 D.目前制取效率高成本低
相关试题

