【题目】为了探究铁、铜、银的活动性顺序,小松同学和小雷同学做了如下实验。请回答下列问题及填写相关空白。
(实验探究)小松同学向盛有硫酸铜和氯化钠溶液的烧杯中插入银片和铁片,发生反应的化学方程式为______。根据______的现象,判断出铁、铜、银的活动性顺序为:铁>铜>银。

(交流讨论)小雷同学想探究一下取出金属片后C烧杯内物质的成分,并进行了如下猜想:
猜想一:NaCl、FeSO4
猜想二:NaCl、CuSO4
猜想三:NaCl、CuSO4、FeSO4
小松认为猜想______一定是错误的,理由是______;
(归纳总结)你认为分析反应后所得溶液中溶质的成分时需要考虑的物质是______;
(表达交流)总结小松和小雷同学的探究历程,猜想一和猜想三都有可能是正确的,有关化学反应后溶液中溶质的成分的猜想,你能总结关于溶液中溶质的成分的猜想的规律是______。
参考答案:
【答案】CuSO4+Fe=FeSO4+Cu 铁片表面覆盖一层紫红色固体,溶液的颜色由蓝色变为浅绿色 二 烧杯中一定含有反应生成的硫酸亚铁 可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质 可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有
【解析】
铁和硫酸铜反应生成硫酸亚铁和铜,银不能和硫酸铜反应;反应后所得溶液中溶质的成分时需要考虑的物质是可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质;关于溶液中溶质的成分的猜想的规律是可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有。
(1)铁和硫酸铜反应生成硫酸亚铁和铜,反应的化学方程式为:CuSO4+Fe=FeSO4+Cu;
(2)实验过程中,铁片表面覆盖一层紫红色固体,溶液的颜色由蓝色变为浅绿色,是因为铁和硫酸铜反应生成硫酸亚铁和铜,说明铁比铜活泼;银片表面无明显变化,说明银不能和硫酸铜反应,进一步说明铜比银活泼,因此判断出铁、铜、银的活动性顺序为:铁>铜>银;
(3)猜想二一定是错误的;
(4)理由是烧杯中一定含有反应生成的硫酸亚铁;
(5)分析反应后所得溶液中溶质的成分时需要考虑的物质:可溶性的生成物、剩余的可溶性反应物、不参加反应的可溶性物质;
(6)关于溶液中溶质的成分的猜想的规律是:可溶性生成物一定含有,可溶于水的反应物可能含有,不参加反应的可溶于水物质一定含有。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有稀盐酸、高锰酸钾、石灰石、火柴、药匙、棉花、镊子及下列仪器:
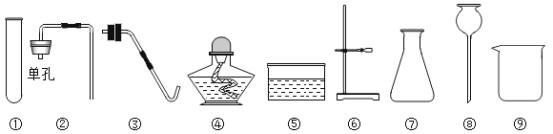
(1)若利用上述仪器和药品制取氧气,还需要补充一种仪器是①_____(填仪器名称),发生反应的化学方程式为②_____。检查装置气密性的原理是:试管内空气受热膨胀,气压③_____,④_____外压,在压强差的作用下,试管内气体逸出。
(2)若利用上述仪器和药品制取并检验二氧化碳,为了便于随时添加液体药品,需要①_____更换成②_____,还需要补充一种溶液,该溶液的俗称是③_____。④请连接图中的A、B,并将实验装置图补充完整__________。B中可观察到的实验现象是⑤_____。
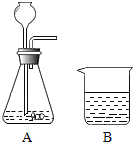
-
科目: 来源: 题型:
查看答案和解析>>【题目】分类、类比是初中化学常用的学习方法。
(1)初中化学有许多实验,若按照实验方法分类,可将实验①_____(填字母)分为一类;分类的依据是②_____;
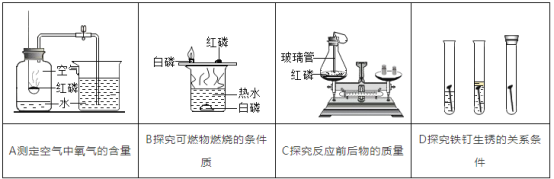
(2)初中化学中我们已经学过了氧化物,若根据性质分,可以把氧化物分为:酸性氧化物和碱性氧化物等,其中酸性氧化物指的是:能与碱反应生成盐和水的氧化物叫酸性氧化物。反应过程中各元素的化合价不变,如P2O5就是酸性氧化物。请写出P2O5与氢氧化钠溶液反应的化学方程式①_____。氧化铜是一种碱性氧化物,请根据氧化铜与酸反应的生成物,推测碱性氧化物的定义是②_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】现有铜和氧化铜的固体混合物粉末,为研究其组成情况,进行如下实验,请回答下列问题:
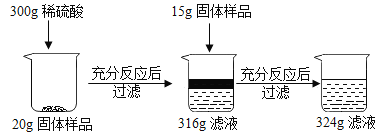
(1)上述实验过程中发生反应的化学方程式为______。
(2)样品中单质Cu的质量分数是______;
(3)第一次反应后所得316g滤液中的溶质是______
(4)根据已知条件列出求解300g稀硫酸中溶质质量(X)的比例式______。
(5)若向最终滤液中加入76g水,所得不饱和溶液中溶质的质量分数为_____
(6)配制上述所需的稀硫酸,需要质量分数为98%的浓硫酸和水的质量比是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)工业上制备K2SO4晶体的工艺流程图如下。

请根据流程回答问题:
(1)将CaCO3研成粉末的目的是 。
(2)写出反应Ⅰ中的化学方程式__________________ ________。
(3)上述流程中可循环使用的物质有CaCO3和 (填化学式)。
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是 。为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入______(填序号),振荡、静置,再向上层清液中滴加AgNO3溶液 ,观察现象即可判断。
a.过量的BaCl2溶液 b.过量的Ba(NO3)2溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】若将50g18%的NaOH溶液与50g18%的盐酸混和,下列叙述正确的是
A. 混合溶液的pH=7 B. 混合溶液中生成物的溶质质量分数仍为18%
C. 溶液混合前后的温度不变 D. 混合溶液的质量为100g
-
科目: 来源: 题型:
查看答案和解析>>【题目】向一定质量的Na2CO3、Na2SO4混合溶液中先后滴加BaCl2、HCl溶液,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示,下列说法正确到是( )
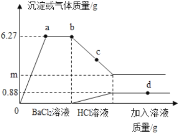
A. 0﹣a段发生了一个反应
B. c点沉淀的成分为一种
C. 取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量
D. m=2.33
相关试题

