【题目】若将50g18%的NaOH溶液与50g18%的盐酸混和,下列叙述正确的是
A. 混合溶液的pH=7 B. 混合溶液中生成物的溶质质量分数仍为18%
C. 溶液混合前后的温度不变 D. 混合溶液的质量为100g
参考答案:
【答案】D
【解析】设50g18%的NaOH溶液与盐酸中氯化氢反应的质量 为x,生成氯化钠的质量为y。
HCl+NaOH═NaCl+H2O
36.540 58.5
x50g×18% y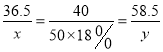
x=8.2125g
y=13.1625g
50g×18%>8.2125g,故反应后盐酸剩余,溶液显酸性。
A、50g18%的NaOH溶液与50g18%的盐酸反应后,盐酸剩余,溶液显酸性,混合溶液的pH<7,错误;B、反应后生成物的溶质质量分数为: ![]() =13.1625%,错误;C、氢氧化钠与盐酸反应放出热量,反应后溶液的温度升高,错误;D、根据质量守恒定律,反应后物质的总质量不变,混合后溶液的总质量为100g,正确。故选D。
=13.1625%,错误;C、氢氧化钠与盐酸反应放出热量,反应后溶液的温度升高,错误;D、根据质量守恒定律,反应后物质的总质量不变,混合后溶液的总质量为100g,正确。故选D。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A~J均为初中常见化学物质:它们之间的转化关系如图所示,部分产物已省略。已知A是人体胃酸的主要成分,B是由四种元素组成的盐类,C是一切生命生存所必须的物质,E是厨房重要的调味品。请回答下列问题:
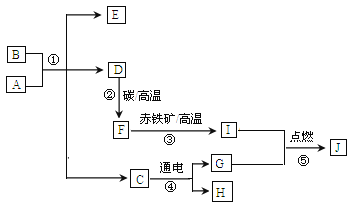
(1)物质F____________,H_________(用化学式表示)。
(2)A和B反应的化学方程式为_____________。
(3)①~⑤属于分解反应的是________________。
(4)A和J反应可生成两种不同盐类,两者所含元素种类相同,但其比例不同,则A何J反应的化学方程式为_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铝合金是目前广泛使用的合金材料,已知某铝合金由Al、Fe、Cu三种金属构成,为了测定各种金属含量,取12.5g合金样品与盐酸反应,消耗浓盐酸(质量分数36.5%)100g。另取12.5g合金样品与氢氧化钠溶液反应,消耗含氢氧化钠12g的溶液40mL。
已知:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,Fe,Cu均不与氢氧化钠溶液反应。
请问:(1)12.5g样品中含铝多少克?
(2)铜在合金中所占的质量分数是多少?
-
科目: 来源: 题型:
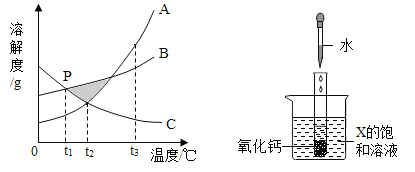
查看答案和解析>>【题目】已知A、B、C三种物质的溶解度曲线如图所示。
(1)在阴影区域部分,处于不饱和状态的是__________(选填“A、B盐酸反应生成、C”)。
(2)若饱和A溶液中含有少量的C,提纯A的方法为______结晶,过滤。
(3)P点表示的含义为_________。
(4)在t1℃下,B、C的饱和溶液升温至t2℃,所得溶液溶质的质量分数大小关系为_______。
(5)向试管中滴入2mL水后,若X中有固体析出,则X为______(选填“A、B、C”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是给病人输液用的氯化钠注射液的标签(部分文字)

(1)要配制1000毫升这种注射溶液(密度为1克/厘米3),需氯化钠多少克?
(2)小明同学从某医院取来了氯化钠注射溶液65克;滴入足量的AgNO3溶液,充分反应后得到沉淀1.435克。通过计算,判断取来的注射液中氯化钠的含量是否达到要求。
-
科目: 来源: 题型:
查看答案和解析>>【题目】2003年重庆开县天然气发生井喷,喷出的气体中含有高浓度的硫化氢气体,该气体有毒,可燃烧产生二氧化硫和水,若当时及时点燃天然气,处理得当就不会造成大量人员伤亡。
⑴请写出硫化氢燃烧的化学方程式_____________________。
⑵反应前后各物质的化学计量数之和为___________。
⑶硫化氢的水溶液称为氢硫酸,能与NaOH溶液发生中和反应,反应的化学方程式是_______________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】小强设计了一个有趣的实验(如下图所示),经过很长一段时间后,他观察到小试管内有晶体析出。

⑴下面是小强对这种现象解释的部分内容,请你帮他把其余的解释内容续写完整:浓硫酸具有吸水性,____________________________。
⑵若实验前后温度不变,则实验后的硝酸钾溶液的溶质质量分数________(填“大于”、“等于”或“小于”)原饱和硝酸钾溶液的溶质质量分数。
相关试题

