【题目】现有铜和氧化铜的固体混合物粉末,为研究其组成情况,进行如下实验,请回答下列问题:
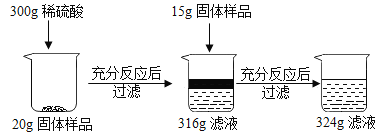
(1)上述实验过程中发生反应的化学方程式为______。
(2)样品中单质Cu的质量分数是______;
(3)第一次反应后所得316g滤液中的溶质是______
(4)根据已知条件列出求解300g稀硫酸中溶质质量(X)的比例式______。
(5)若向最终滤液中加入76g水,所得不饱和溶液中溶质的质量分数为_____
(6)配制上述所需的稀硫酸,需要质量分数为98%的浓硫酸和水的质量比是______。
参考答案:
【答案】CuO+H2SO4=CuSO4+H2O 20% CuSO4、H2SO4 80/98=24g/X 12% 1:9
【解析】
根据300g稀硫酸加入20g固体导致溶液质量增加了16g,说明此时反应的氧化铜的质量为16g。而继续加入15g固体样品,导致溶液质量增加了8g,说明此时稀硫酸完全反应,氧化铜过量。据此结合氧化铜的质量和对应的化学方程式求算稀硫酸中溶质的只以及生成的硫酸铜的质量,进而求算对应的质量分数。
(1)由题意可知,氧化铜能与稀硫酸反应生成了硫酸铜和水,反应的化学方程式是:CuO+H2SO4=CuSO4+H2O;
(2)根据300g稀硫酸加入20g固体导致溶液质量增加了16g,说明此时反应的氧化铜的质量为16g;而继续加入15g固体样品,导致溶液质量增加了8g,反应的氧化铜的总质量为16g+8g=24g,说明此时稀硫酸完全反应,氧化铜过量;样品中铜的质量分数是![]()
![]() 100%=20%;
100%=20%;
(3)根据上面的分析可知,第一次反应后所得316g滤液中的溶质是:剩余的H2SO4和生成的CuSO4;
(4)设稀硫酸中溶质质量为x,生成硫酸铜的质量为y,
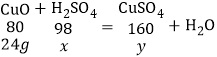
![]() x=29.4g,
x=29.4g,
![]() y=48g,
y=48g,
(5)向最终滤液中加入76g水,所得不饱和溶液中溶质的质量分数为:![]() ×100%=12%;
×100%=12%;
(6)稀硫酸的溶质质量分数是:![]() ×100%=9.8%;设配制上述所需的稀硫酸需要质量分数为98%的浓硫酸和水的质量分别为m、n,则:
×100%=9.8%;设配制上述所需的稀硫酸需要质量分数为98%的浓硫酸和水的质量分别为m、n,则:![]() ×100%=9.8%,
×100%=9.8%,![]() =
=![]() 。
。
-
科目: 来源: 题型:
查看答案和解析>>【题目】从微观角度探析宏观的变化是化学学习的特点之一,请据表回答:
甲
乙

实验一:水沸腾实验二:水的分解

(1)乙中的微观过程对应甲中的实验______(选填“一”或“二”);
(2)请你将乙中的B图缺少的粒子补全______;
(3)在此变化中不发生改变的粒子是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室现有稀盐酸、高锰酸钾、石灰石、火柴、药匙、棉花、镊子及下列仪器:
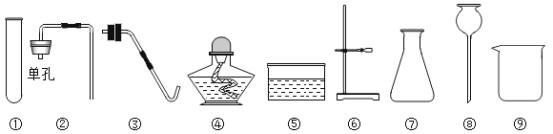
(1)若利用上述仪器和药品制取氧气,还需要补充一种仪器是①_____(填仪器名称),发生反应的化学方程式为②_____。检查装置气密性的原理是:试管内空气受热膨胀,气压③_____,④_____外压,在压强差的作用下,试管内气体逸出。
(2)若利用上述仪器和药品制取并检验二氧化碳,为了便于随时添加液体药品,需要①_____更换成②_____,还需要补充一种溶液,该溶液的俗称是③_____。④请连接图中的A、B,并将实验装置图补充完整__________。B中可观察到的实验现象是⑤_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分类、类比是初中化学常用的学习方法。
(1)初中化学有许多实验,若按照实验方法分类,可将实验①_____(填字母)分为一类;分类的依据是②_____;
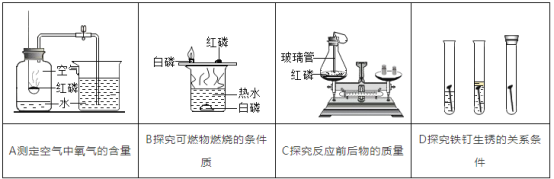
(2)初中化学中我们已经学过了氧化物,若根据性质分,可以把氧化物分为:酸性氧化物和碱性氧化物等,其中酸性氧化物指的是:能与碱反应生成盐和水的氧化物叫酸性氧化物。反应过程中各元素的化合价不变,如P2O5就是酸性氧化物。请写出P2O5与氢氧化钠溶液反应的化学方程式①_____。氧化铜是一种碱性氧化物,请根据氧化铜与酸反应的生成物,推测碱性氧化物的定义是②_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究铁、铜、银的活动性顺序,小松同学和小雷同学做了如下实验。请回答下列问题及填写相关空白。
(实验探究)小松同学向盛有硫酸铜和氯化钠溶液的烧杯中插入银片和铁片,发生反应的化学方程式为______。根据______的现象,判断出铁、铜、银的活动性顺序为:铁>铜>银。

(交流讨论)小雷同学想探究一下取出金属片后C烧杯内物质的成分,并进行了如下猜想:
猜想一:NaCl、FeSO4
猜想二:NaCl、CuSO4
猜想三:NaCl、CuSO4、FeSO4
小松认为猜想______一定是错误的,理由是______;
(归纳总结)你认为分析反应后所得溶液中溶质的成分时需要考虑的物质是______;
(表达交流)总结小松和小雷同学的探究历程,猜想一和猜想三都有可能是正确的,有关化学反应后溶液中溶质的成分的猜想,你能总结关于溶液中溶质的成分的猜想的规律是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】(5分)工业上制备K2SO4晶体的工艺流程图如下。

请根据流程回答问题:
(1)将CaCO3研成粉末的目的是 。
(2)写出反应Ⅰ中的化学方程式__________________ ________。
(3)上述流程中可循环使用的物质有CaCO3和 (填化学式)。
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的原因是 。为检验硫酸钾晶体是否洗涤干净,可取最后一次洗涤液,先加入______(填序号),振荡、静置,再向上层清液中滴加AgNO3溶液 ,观察现象即可判断。
a.过量的BaCl2溶液 b.过量的Ba(NO3)2溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】若将50g18%的NaOH溶液与50g18%的盐酸混和,下列叙述正确的是
A. 混合溶液的pH=7 B. 混合溶液中生成物的溶质质量分数仍为18%
C. 溶液混合前后的温度不变 D. 混合溶液的质量为100g
相关试题

