【题目】在2016年巴西里约奥运会上,小红与同学发现游泳池池内水呈蓝色,对“蓝色水”产生好奇,于是她用一个洗净的可乐瓶装满一瓶“蓝色水”,进行探究:
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是_____。
[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。
[设计方案]请你帮助小红完成实验报告
实验方法 | 观察到的现象 | 实验结论 |
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。 | 铁丝表面变成___ 色 | 溶质中含有铜离子 |
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸 | 白色沉淀 | 溶质中含有的阴离子是__________。 |
[结论与应用]“蓝色水”中溶质的化学式是__________。该物质可以做过氧化氢溶液制氧气反应催化剂,写出此反应的化学方程式_____________________________。
参考答案:
【答案】CuSO4 红 硫酸根离子 CuSO4 2H2O2 ![]() 2H2O + O2↑
2H2O + O2↑
【解析】
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是CuSO4 。[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。[设计方案]
实验方法 | 观察到的现象 | 实验结论 |
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。 | 铁丝表面变成红色 | 溶质中含有铜离子 |
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸 | 白色沉淀 | 溶质中含有的阴离子是硫酸根离子。 |
[结论与应用]“蓝色水”中溶质的化学式是CuSO4。该物质可以做过氧化氢溶液制氧气反应催化剂,此反应的化学方程式是2H2O2 ![]() 2H2O + O2↑。
2H2O + O2↑。
点睛∶本题主要考查硫酸铜的性质。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A.、B、C、E、F、G、H、I都是初中化学学过的物质。其中E、F、H均为黑色固体,B为红色固体单质。他们之间有如图的转化关系(部分生成物已省去)
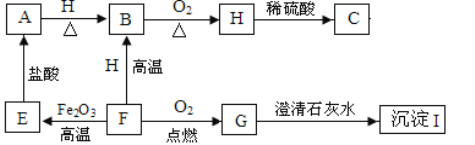
(1)请用化学式表示下列物质:
A___________ 、 B _________ 、I__________。
(2)写出下列转变的化学方程式:
E→A______________________________;
H→C______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】神舟六号载人飞船成功返航,标志着我国已跨入航天领域国际领先行列。
[提出问题]宇航员呼吸所需的氧气哪里来的呢?
[查阅资料]超氧化钾(KO2)是一种氧气再生剂,这种固体与人体呼出的二氧化碳反应生成氧气:4KO2 + 2CO2 ==== 2K2CO3 + 3O2
[实验验证]研究性学习小组的同学设计了下图实验装置:
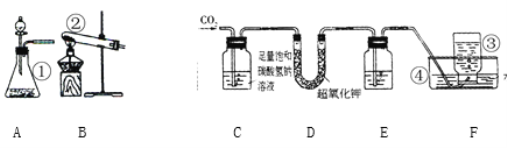
(1)写出上图有标号的仪器名称:
①_________; ②_________; ③_________; ④_________;
(2)从A、B两种装置中选择_____作二氧化碳发生装置,此装置制取二氧化碳的化学方程式为___________________________。
(3)二氧化碳不溶于饱和碳酸氢钠溶液,装置C的作用是______________________。
(4)为了得到较纯净的氧气,装置E中可盛入过量______________。
(5)取出装置F中装有气体仪器后,检验得到气体的方法_________________。
[反思与评价]宇宙飞船中用超氧化钾获得氧气的优点有__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究氧化铜与碳反应生成的气体产物,甲同学设计并进行了如下实验:取一定量氧化铜和碳的混合粉末,在不含氧气的高温条件下反应,将生成的气体通入澄清石灰水,发现石灰水变浑浊。由此得出结论,生成的气体产物一定是CO2。
①甲同学加热混合粉末时观察到的现象是:黑色粉末___________,澄清石灰水变浑浊。
②检验气体产物是CO2的另一种方法是:将生成的气体通入石蕊溶液中,溶液变________色。
③乙同学认为,甲同学的实验不能证明反应的气体产物只有CO2,乙同学推测气体产物中可能还有CO。请你从下列A、B、C中选择实验装置,用于验证乙同学的推测。将所选装置的编号填入方框(1),并在方括号内写出相应装置内盛放的化学试剂:装置_______。
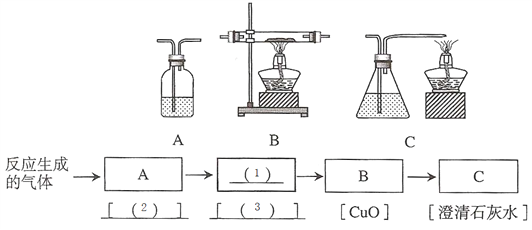
④试剂(2)是___________ ,其作用是__________________________;
⑤试剂(3)是___________ ,其作用是__________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】石灰石是我市主要矿产之一,小江同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如下定量实验。
实验步骤
①将适量盐酸加入烧杯中并称重
②称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应
③待反应完全后,称重
实验图示
实验数据
烧杯和盐酸的质量为100.0g
石灰石样品的质量为12.0g
烧杯和其中混合物的质量为107.6g
试通过分析计算(结果保留一位小数):
(1)该实验中生成的二氧化碳的质量是___________。
(2)试通过计算推断该石灰石样品的纯度是否符合要求?(样品中的杂质不与盐酸反应)
(3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是 (石灰石样品中的杂质不含钙)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】分析下图中NaCl、KNO3的溶解度曲线,回答问题。
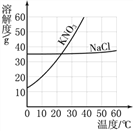
(1)10℃时,100g水中最多溶解KNO3约______g;
(2)溶解度受温度变化影响较小的是______;
(3)NaCl溶液中含有少量KNO3,提纯NaCl,采用的方法是______(选填“蒸发结晶”或“降温结晶”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合配制溶质质量分数一定的氯化钠溶液的实验图示,回答下列有关问题:

(1)配制200g质量分数为9%的NaCl溶液,需NaCl______g;
(2)在量取水的操作中,当水面接近所需刻度时,应使用______滴加;
(3)操作D中用玻璃棒搅拌的作用是______;
(4)上图操作中,一定能导致溶质质量分数偏小的是______。
相关试题

