【题目】分析下图中NaCl、KNO3的溶解度曲线,回答问题。
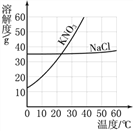
(1)10℃时,100g水中最多溶解KNO3约______g;
(2)溶解度受温度变化影响较小的是______;
(3)NaCl溶液中含有少量KNO3,提纯NaCl,采用的方法是______(选填“蒸发结晶”或“降温结晶”)。
参考答案:
【答案】20 氯化钠 蒸发结晶
【解析】
(1)溶解度是一定温度下,100g溶剂里达到饱和时,所溶解的溶质的质量。由图可知10℃时硝酸钾的溶解度为20g,100g水中最多溶解KNO3约20g;(2)溶解度受温度变化影响较小的是氯化钠;(3)NaCl溶液中含有少量KNO3,由于硝酸钾的溶解随温度升高而急剧增大,而氯化钠的溶解度几乎不受温度影响,提纯NaCl,采用的方法是蒸发结晶。
-
科目: 来源: 题型:
查看答案和解析>>【题目】为了探究氧化铜与碳反应生成的气体产物,甲同学设计并进行了如下实验:取一定量氧化铜和碳的混合粉末,在不含氧气的高温条件下反应,将生成的气体通入澄清石灰水,发现石灰水变浑浊。由此得出结论,生成的气体产物一定是CO2。
①甲同学加热混合粉末时观察到的现象是:黑色粉末___________,澄清石灰水变浑浊。
②检验气体产物是CO2的另一种方法是:将生成的气体通入石蕊溶液中,溶液变________色。
③乙同学认为,甲同学的实验不能证明反应的气体产物只有CO2,乙同学推测气体产物中可能还有CO。请你从下列A、B、C中选择实验装置,用于验证乙同学的推测。将所选装置的编号填入方框(1),并在方括号内写出相应装置内盛放的化学试剂:装置_______。
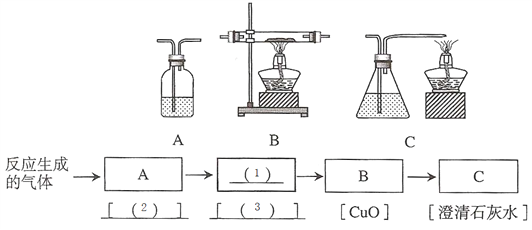
④试剂(2)是___________ ,其作用是__________________________;
⑤试剂(3)是___________ ,其作用是__________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在2016年巴西里约奥运会上,小红与同学发现游泳池池内水呈蓝色,对“蓝色水”产生好奇,于是她用一个洗净的可乐瓶装满一瓶“蓝色水”,进行探究:
[提出问题]“蓝色水”中的溶质是什么?
[猜想]小红经过查阅资料和自己学过的化学知识,她猜溶质可能是_____。
[查阅资料]含有铜离子的溶液一般呈蓝色。碳酸钡、硫酸钡都是白色沉淀,硫酸钡还不溶于稀硝酸。
[设计方案]请你帮助小红完成实验报告
实验方法
观察到的现象
实验结论
把少量的“蓝色水”注入试管中,插入一根光亮的铁丝。
铁丝表面变成___
色
溶质中含有铜离子
把少量的“蓝色水”注入试管中,滴入硝酸钡溶液和稀硝酸
白色沉淀
溶质中含有的阴离子是__________。
[结论与应用]“蓝色水”中溶质的化学式是__________。该物质可以做过氧化氢溶液制氧气反应催化剂,写出此反应的化学方程式_____________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】石灰石是我市主要矿产之一,小江同学为了寻找含碳酸钙质量分数超过85%的石灰石,对一样品进行了如下定量实验。
实验步骤
①将适量盐酸加入烧杯中并称重
②称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应
③待反应完全后,称重
实验图示
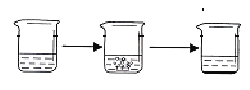
实验数据
烧杯和盐酸的质量为100.0g
石灰石样品的质量为12.0g
烧杯和其中混合物的质量为107.6g
试通过分析计算(结果保留一位小数):
(1)该实验中生成的二氧化碳的质量是___________。
(2)试通过计算推断该石灰石样品的纯度是否符合要求?(样品中的杂质不与盐酸反应)
(3)若碳酸钙质量分数超过85%的石灰石其含钙的质量分数为a% ,则a的取值范围是 (石灰石样品中的杂质不含钙)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合配制溶质质量分数一定的氯化钠溶液的实验图示,回答下列有关问题:

(1)配制200g质量分数为9%的NaCl溶液,需NaCl______g;
(2)在量取水的操作中,当水面接近所需刻度时,应使用______滴加;
(3)操作D中用玻璃棒搅拌的作用是______;
(4)上图操作中,一定能导致溶质质量分数偏小的是______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】图中A—G是初中化学常见的物质,且分别是由H、C、O、Na、S、Cu中的一种或几种元素组成。A、C为单质;B、D、E由两种元素组成,其中E中两种元素质量比为1:8;F、G、H由三种元素组成,H可用于含铅蓄电池中。图中“—”表示两端的物质间能发生化学反应;“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
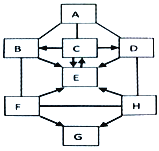
(1)写出化学式:E____________。
(2)写出B物质的一种用途:____________。
(3)写出H和D反应的化学方程式_____________。
(4)写出E→C反应的化学方程式_____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】有关物质组成及化学规律的发现对化学的发展做出了重要贡献。
(1)法国化学家拉瓦锡为化学学科的发展做出了巨大贡献,下列有关发现与他有密切关系的是_____。
A. 空气的组成 B. 质量守恒定律 C. 水的组成 D. 酸碱指示剂
(2)在密闭容器内加入下列两种物质,并称量加入前后的总质量(含密闭容器),能验证质量守恒定律的是_____________(填标号)。
A. 蔗糖和水 B. 氯化钠溶液和硝酸钾溶液 C. 氯化钡溶液和稀硫酸
(3)在氧气中点燃红磷的实验过程,固体质量变化如图所示。
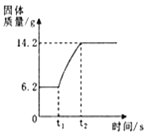
①从燃烧条件分析,固体质量在t1前没有发生变化的原因是___________。
②该反应的化学方程式为________________。
③参加反应的氧气质量为___________g。
(4)某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。
查阅资料可知Mg、Mg3N2能发生如下反应:
①2Mg+O2 △ 2MgO; ②3Mg+N2 △ Mg3N2; ③2Mg+CO2 △ 2MgO+C
④Mg+H2O △ MgO+H2↑ ⑤Mg3N2+6H2O 3Mg(OH)2↓+2NH3↑
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
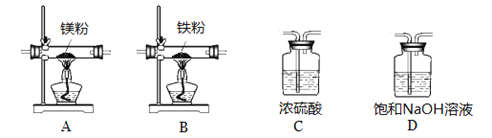
①连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是______(填装置序号)。D装置中发生反应的化学方程式为___________。
②通气后,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_________。
③设计一个实验,验证产物是否含氮化镁:
实验操作和实验现象
实验结论
________________________
产物中含有氮化镁
④思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N的质量,请给出合理的解释_______________。
相关试题

