【题目】如同氧元素一样,碳元素的单质及化合物在生产生活实际中也有着十分广泛的应用。请根据你掌握的知识回答下列问题:
(1)重要档案或票据,一殷都要求运用碳素墨水笔书写,其理论依据是_____。
(2)焦炭是工业上高炉炼铁的重要原料之一,它们在高炉中发生了一系列化学反应,其中CO使氧化铁转化为铁,就是最重要的反应之一,请写出该反应的化学方程式:_____。
(3)小章同学准备在实验室用下图所示装置模拟工业炼铁。
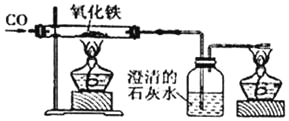
其中:
①实验中产生的现象主要有:_____。
②装置图中澄清石灰水的作用是_____,其中所发生的反应的化学方程式是_____。
③某同学实验完成后,发现过量的澄清石灰水增重4.4g,则该同学通入装置的CO气体质量肯定大于_____,其理由是_____。
参考答案:
【答案】在常温下碳的化学性质不活泼,能保存长久不褪色 Fe2O3+3CO![]() 2Fe+3CO2 红色固体变黑、澄清石灰水变浑浊 检验产物二氧化碳 CO2+Ca(OH)2═CaCO3↓+H20 2.8g 有一部分一氧化碳没有参加反应
2Fe+3CO2 红色固体变黑、澄清石灰水变浑浊 检验产物二氧化碳 CO2+Ca(OH)2═CaCO3↓+H20 2.8g 有一部分一氧化碳没有参加反应
【解析】
(1)在书写具有保存价值的档案时,规定使用碳素墨水,这是因为在常温下碳的化学性质不活泼,能保存长久不褪色;
(2)仔细分析炼铁高炉中反应可知,碳首先生成二氧化碳放出大量的热量,可供还原铁矿石提供热量,然后和焦炭反应生成CO,然后再还原还原铁矿石。炼铁原理的化学方程式为:Fe2O3+3CO ![]() 2Fe+3CO2
2Fe+3CO2
(3)①实验中产生的现象主要有:红色固体变黑、澄清石灰水变浑浊;
②装置图中澄清石灰水的作用是检验产物二氧化碳;则化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
③某同学实验完成后,发现“过量的澄清石灰水增重4.4g”,根据Fe2O3+3CO![]() 2Fe+3CO2可知,并且一氧化碳反应前和反应后,都得通入一会儿,故一氧化碳要过量;则该同学通人装置的CO气体质量大于2.8g,原因是有一部分一氧化碳没有参加反应。
2Fe+3CO2可知,并且一氧化碳反应前和反应后,都得通入一会儿,故一氧化碳要过量;则该同学通人装置的CO气体质量大于2.8g,原因是有一部分一氧化碳没有参加反应。
故答案为:(1)在常温下碳的化学性质不活泼,能保存长久不褪色;
(2)Fe2O3+3CO![]() 2Fe+3CO2。
2Fe+3CO2。
(3)①红色固体变黑、澄清石灰水变浑浊。
② 检验产物二氧化碳,CO2+Ca(OH)2═CaCO3↓+H20。
③ 2.8g,有一部分一氧化碳没有参加反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是工业上制备氢气的微观示意图,其中不同的“球”代表不同的原子,下列说法错误的是( )
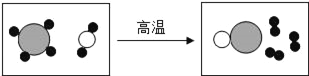
A. 图中能表示氢分子的是“
 ”
”B. 反应前后,原子的种类和数目不变
C. 该反应中参加反应的两种分子的个数比为1:1
D. 该反应中共涉及两种单质和三种化合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】图1是从元素周期表中截取的四种元素的信息,请回答下列问题:
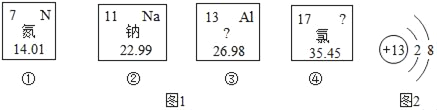
(1)①元素原子的相对原子质量是_____;
(2)③元素的一种微粒的结构示意图如图2,它属于_____(填“金属元素”或“非金属元素”或“稀有气体元素”),该微粒的符号为_____;
(3)由②与④形成化合物的化学式是_____,是由_____ (原子、分子、离子)构成。
-
科目: 来源: 题型:
查看答案和解析>>【题目】复方冬青软膏具有强力迅速镇痛作用,其有效成分A的分子模型如图所示。
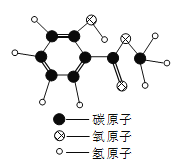
(1)A物质属于_____物(填“纯净”或“混合”)。
(2)A物质的化学式为_____。
(3)A物质中碳、氢的原子个数比为_____(填最简比)。
(4)A物质中碳元素的质量分数为_____(结果精确到0.1%)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下列装置如图1,回答问题:
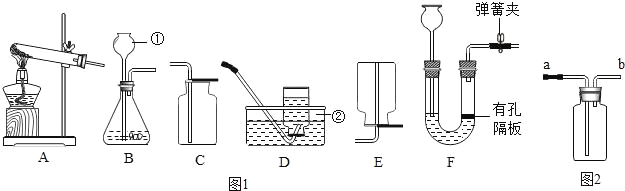
(1)写出标号①②的仪器名称:①_____,②_____.
(2)某同学想要用高锰酸钾制制取一瓶较干燥的氧气,他应该选择_____组合.装置A还需做的一点改动是_____,写出高锰酸钾制取氧气的化学方程式_____.
(3)如果选择BD组合可以制取_____气体,写出该反应的化学方程式_____.
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过溶解、过滤、_____干燥就能得到纯净的二氧化锰固体.
(5)把(4)中滤液蒸发结晶可得到氯化钾晶体,在蒸发操作中玻璃棒的作用是_____.
(6)若选择装置F作为制取氢气的发生装置,其优点是_____.如果如图2所示的装置来收集一瓶氧气,验满时应该将带火星的木条放在_____.(选填“a”或“b”)导管口处.
-
科目: 来源: 题型:
查看答案和解析>>【题目】(9分)水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
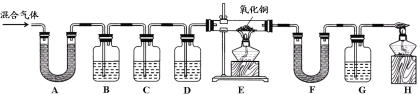
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有 。B中变化的化学方程式为 。
(2)装置C中的药品为 。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是 ; E中的变化说明氧化铜具有 性。
【实验结论】猜想 正确。
【实验反思】
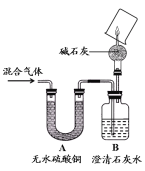
经过讨论,同学们将上图中装置C~H进行了简化,只 用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为 , 烧杯上能观察到的现象是 。最后一步的实验操作及现象是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A﹣E都是初中化学中的常见物质,其中A和D是无色无味气体,B是黑色粉末,C是红色固体,它们的转化关系如图所示(部分反应的反应条件或生成物已省略).
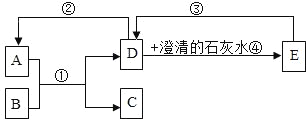
(1)写出C物质的化学式:_____.
(2)写出反应①的化学方程式:_____;若反应③的反应条件是高温,请写出反应③的化学方程式:_____,属于_____反应(填基本反应类型).
(3)D能转化为A,还需要的物质是_____.
相关试题

