【题目】复习课上,老师要求学生用不同的方法鉴别稀硫酸和氢氧化钠溶液。小东、小南两位同学取同一溶液分别进行如下实验:
【实验方案】
实验步骤 | 实验现象 | 实验结论 | |
小东 | 用玻璃棒蘸取溶液滴到pH试纸上,对照比色卡并读出pH | pH试纸变色 pH 7(填“>”或“<”) | 该溶液是氢氧化钠溶液 |
小南 | 取适量溶液于试管中,加入经打磨过的铝条 | 有气泡产生 | 该溶液是稀硫酸 |
【提出问题】为什么我们取相同溶液而实验结论却不同呢?
【解决问题】
小东、小南讨论后决定再用硫酸铜溶液进一步验证,结果观察到的现象是 ,于是一致认为该溶液是氢氧化钠溶液。为什么小南加入铝条会有气泡产生呢?通过查阅资料,他们发现初中常见金属中只有铝能与酸、碱反应,铝与氢氧化钠溶液反应的化学方程式是:2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 。
【拓展延伸】利用稀硫酸和氢氧化钠溶液两种溶液,测定镁铝铜合金中各成分的含量。实验设计如下:

【回答问题】
(1)写出操作I中玻璃棒的作用: ;
(2)a溶液是 ,选择该溶液的理由是 ;
(3)金属铜的质量为 g,固体A含有的物质是 ,溶液A中所含溶质是 。
参考答案:
【答案】【实验方案】 >【解决问题】有蓝色沉淀产生【回答问题】(1)引流 (2)氢氧化钠溶液;只有金属铝能与氢氧化钠溶液反应产生氢气,通过生成氢气质量方可求出铝质量(3) 0.5 ; Mg、Cu ((2分); NaOH、NaAlO2
【解析】
试题分析:【实验方案】中结论为氢氧化钠溶液,故溶液的PH大于7;【解决问题】用硫酸铜溶液进一步验证,观察到有蓝色沉淀产生,说明该溶液为氢氧化钠溶液;【回答问题】(1)在过滤中玻璃棒的作用是引流;(2)依据题中提供的资料可知,a溶液为氢氧化钠溶液;选择该溶液的理由为只有金属铝能与氢氧化钠溶液反应产生氢气,通过生成氢气质量方可求出铝质量 (3)因为金属铜不与盐酸溶液反应,反应后剩余的固体为金属铜的质量故为 0.5g ; 固体A中含有的物质Mg、Cu ;溶液A中所含溶质是过量的氢氧化钠和生成的偏铝酸钠 两种溶质。
-
科目: 来源: 题型:
查看答案和解析>>【题目】城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如下:
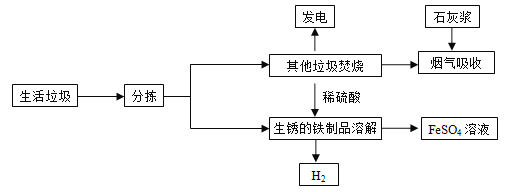
资料1:垃圾焚烧产生的烟气中含有SO2、HCl等有害气体
资料2:+2价的铁元素容易被空气中的氧气氧化;
单质铁能与硫酸铁反应Fe+Fe2(SO4)3═3FeSO4
资料3:SO2与CO2的化学性质相似
资料4:石灰浆的主要成分是氢氧化钙
回答下列问题:
(1)吸收步骤中,石灰浆的作用是 ;
(2)除资料2外,溶解步骤中发生反应的化学方程式为 ; ;
(3)将所得硫酸亚铁溶液在氮气环境中加热蒸发浓缩、冷却结晶等操作,得到硫酸亚铁晶体,其中氮气的作用是 ;
(4)请你就如何处理我们日常生活垃圾提一条建议 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫代硫酸钠(Na2S2O3),又名大苏打、海波。关于该物质的说法合理的是
A.该物质含有硫元素、钠元素、氧元素
B.该物质是氧化物
C.该物质中含有臭氧分子(O3)
D. 该物质是由硫原子、钠原子、氧原子构成
-
科目: 来源: 题型:
查看答案和解析>>【题目】用氢氧化钠溶液、稀盐酸和酚酞溶液.按如图步骤进行实验,回答下列问题

(1)无色溶液A是 ,仪器C的名称是 ;
(2)实验步骤②和③两次使用了滴管,用完后需要洗涤的是 (填②或③);
(3)实验中反应的化学方程式是 ;
(4)步骤⑤的操作名称是 ,当出现较多量固体时应 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示。回答下列问题:

(1)从图中看出生成沉淀的最大质量是 g;
(2)开始加入碳酸钠溶液至10g时,还没有沉淀析出的原因是 ;
(3)计算原滤液中氯化钙的质量分数。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列说法不正确的是
A.单质铁能从硫酸铜溶液中把铜置换出来
B.能使无色酚酞溶液变红的物质,一定是碱溶液
C.碘是人体必须的微量元素,缺碘会引起甲状腺肿大
D.燃烧必须同时满足两个条件:可燃物与氧气接触、可燃物的温度达到着火点
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫化氢(H2S)是一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸(H2SO4)混合,在常温下通过发生复分解反应制得硫化氢气体
试回答:
(1)根据装置图回答下列问题:

①通过发生装置A和B的对比,可总结出选择气体发生装置应考虑的因素是_____________和_____________.
②若用C装置收集硫化氢气体,进气口应为____,原因是________________________;
③为了验证硫化氢的水溶液呈酸性,可以将该气体通入装置D,D中所盛的试剂应该是_____________________,现象是_______________________________;
④做上述实验时,为了防止多余的硫化氢逸出污染环境,可以将其通入装置E吸收,E中漏斗的作用为_______________________________________________;
(2)工业上用候氏制碱法制得的纯碱样品中含有一定量的氯化钠。现称取只含有氯化钠杂质的纯碱样品23.3g,放入盛有146g稀盐酸的烧杯中,恰好完全反应。反应后溶液的质量为160.5g。试计算:所用稀盐酸中溶质的质量分数。
相关试题

