【题目】了解金属性质是合理利用金属资源的关键。请回答下列问题:
(1)将一片铝箔在空气中用酒精灯加热,观察到铝箔表面变暗,化学反应方程式为:____________,铝箔内部熔化但不滴落,这是由于____________。若将另一片同样大小的铝箔伸入到充满氧气的集气瓶中,引燃,观察到铝箔剧烈燃烧,发出耀眼白光,说明铝和氧气反应的剧烈程度与氧气的____________有关。
(2)为了验证铝、锌、铜三种金属的活动性顺序,下列四种方案中可行的是____________。
A.将铝、铜分别投入硫酸锌溶液 B.将锌、铜分别投入硫酸铝溶液
C.将锌分别投入硫酸铝、硫酸铜溶液 D.将铜分别投入硫酸铝、硫酸锌溶液
(3)已知久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3]。某同学对铜生锈条件进行探究,设计如下图所示四个实验。若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现。
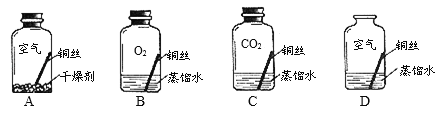
①实验C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是____________;
②B瓶与D瓶中的现象对比,可以得出的结论是__________;
③由上述四个实验可分析得出,铜生锈是铜与空气中的____________共同作用的结果。
参考答案:
【答案】4Al + 3O2 ![]() 2Al2O3铝箔表面形成致密的氧化膜浓度AC除去水中溶解的氧气铜生锈需要二氧化碳氧气、二氧化碳、水
2Al2O3铝箔表面形成致密的氧化膜浓度AC除去水中溶解的氧气铜生锈需要二氧化碳氧气、二氧化碳、水
【解析】(1)将一片铝箔在空气中用酒精灯加热,铝和空气中的氧气反应,生成氧化铝,所以铝箔表面变暗,化学反应方程式为:4Al + 3O2 ![]() 2Al2O3 ;铝箔内部熔化但不滴落,这是由于铝箔表面形成致密的氧化膜;若将另一片同样大小的铝箔伸入到充满氧气的集气瓶中,引燃,观察到铝箔剧烈燃烧,发出耀眼白光,说明铝和氧气反应的剧烈程度与氧气的浓度有关。空气中氧气占21%,集气瓶内几乎是纯氧气,氧气浓度越大,反应物接触越充分,反应越剧烈;(2)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。将铝、铜分别投入硫酸锌溶液 ,铝和硫酸锌反应,证明铝在锌前,铜和硫酸锌不反应,证明铜在锌后,可证明铝>锌>铜;将锌分别投入硫酸铝、硫酸铜溶液 ,锌不与硫酸铝反应,证明锌在铝后,锌和硫酸铜反应,证明锌在铜前,也可证明铝>锌>铜;(3) ①实验C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是除去水中溶解的氧气,证明没有氧气时不能生锈;
2Al2O3 ;铝箔内部熔化但不滴落,这是由于铝箔表面形成致密的氧化膜;若将另一片同样大小的铝箔伸入到充满氧气的集气瓶中,引燃,观察到铝箔剧烈燃烧,发出耀眼白光,说明铝和氧气反应的剧烈程度与氧气的浓度有关。空气中氧气占21%,集气瓶内几乎是纯氧气,氧气浓度越大,反应物接触越充分,反应越剧烈;(2)金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb H Cu Hg Ag Pt Au,在金属活动顺序表中,排在氢前边的金属能和酸发生置换反应生成盐和氢气。金属的位置越靠前,金属的活动性越强。位置靠前的金属能将位于其后的金属从它的盐溶液中置换出来。将铝、铜分别投入硫酸锌溶液 ,铝和硫酸锌反应,证明铝在锌前,铜和硫酸锌不反应,证明铜在锌后,可证明铝>锌>铜;将锌分别投入硫酸铝、硫酸铜溶液 ,锌不与硫酸铝反应,证明锌在铝后,锌和硫酸铜反应,证明锌在铜前,也可证明铝>锌>铜;(3) ①实验C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是除去水中溶解的氧气,证明没有氧气时不能生锈;
② B瓶与D瓶中的现象对比,可以得出的结论是铜生锈需要二氧化碳;因B中没有二氧化碳时不生锈③由上述四个实验可分析得出,铜生锈是铜与空气中的氧气、二氧化碳、水共同作用的结果。因为只有四种物质同时存在使,铜才能生锈。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于氧气的说法正确的是( )
A. 大多数金属能与氧气反应 B. 氧气易溶于水
C. 硫在氧气中燃烧生成三氧化硫 D. 食物腐败不需要氧气
-
科目: 来源: 题型:
查看答案和解析>>【题目】金属R放入稀硫酸中,没有气泡产生,放入硫酸铜溶液中,表面有红色物质析出.下列关于R的金属活动性判断不正确的是( )
A. R>Cu B. R>Fe C. Zn>R D. R>Ag
-
科目: 来源: 题型:
查看答案和解析>>【题目】
【探究一】
小明依据呼出气体成分认为:吹的气流中有较多的 的气体,使蜡烛缺氧熄灭。小聪设计了以下实验方案: ,否定了小明的想法。从而认为蜡烛熄灭是因为吹的气流带走了 ,使温度降到了着火点以下。
【探究二】
小红依据灭火的原理经过进一步思考认为,也可能因为吹的气流移走了可燃物——蜡蒸气,使蜡烛熄灭。为此她查阅了相关资料并进行了以下两个实验:
查阅
资料:蜡烛的着火点大约是190℃,酒精灯火焰的温度在400℃-1000℃;蜡烛燃烧实际是石蜡蒸气在燃烧。
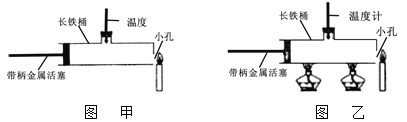
实验1:如图甲,把带柄金属活塞从左端位置迅速向右推,右端蜡烛火焰立即熄灭。
实验2:如图乙,先将带柄金属活塞放到左端位置,点燃酒精灯,当温度计的示数达到280℃以上时,点燃右面的蜡烛,把带柄金属活塞从左端位置迅速向右推出,右端蜡烛火焰立即熄灭。
【实验结论】蜡烛一吹就灭的原因 。
【实验分析、讨论】
(1) 实验2中用两盏酒精灯的目的是 。
(2)小红为验证自己的想法,做了实验1和实验2两个实验,主要是应用了科学探究方法中的 法。
【拓展应用】下列生产生活中灭火方式与上述实验灭火原理一致的是( )
A.消防用大功率风力灭火机灭火
B.用干冰灭火
C.用锅盖盖灭油锅着的火
D.用水灭火
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,从100g20%的某溶液中取出10g,剩下的溶液溶质质量分数为( )
A. 20% B. 18% C. 10% D. 2%
-
科目: 来源: 题型:
查看答案和解析>>【题目】工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:
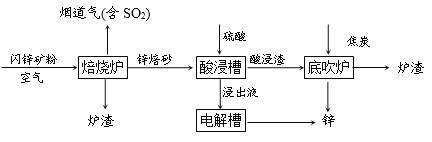
(1)焙烧炉中ZnS转化为ZnO,反应的化学方程式为:____________。
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的浸出液,反应过程中需不断搅拌,其目的是____________。酸浸渣的主要成分是铁酸锌(ZnFe2O4),其中铁元素的化合价为____________。
(3)底吹炉中可以获得锌,发生的反应主要有:
①3ZnFe2O4+ C
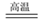 2Fe3O4 +3ZnO+CO
2Fe3O4 +3ZnO+CO ②ZnFe2O4+ CO
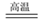 2FeO + ZnO+CO2
2FeO + ZnO+CO2③ZnO+ CO
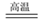 Zn(蒸汽)+CO2
Zn(蒸汽)+CO2经分析,炉渣中除了Fe3O4、FeO等铁的氧化物外,还含有铁的单质,理由是______________
(4)烟道气中的二氧化硫用石灰石浆吸收以防止污染环境,并获得生产石膏的原料硫酸钙,其反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2。若1000 kg废气中含有1.6 kg二氧化硫,计算这些二氧化硫产生硫酸钙的质量。_______ (写出计算过程)
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:草酸钙(CaC2O4)比碳酸钙受热易分解,CaC2O4
 CaCO3+CO↑。将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法正确的是
CaCO3+CO↑。将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法正确的是A. 剩余固体为纯净物
B. 剩余固体中含有钙元素的质量为4.0g
C. 将剩余固体溶于过量的稀盐酸,产生4.4g CO2
D. 加热产生的CO气体为5.0 g
相关试题

