【题目】工业上用闪锌矿(主要成分是ZnS、FeS)冶炼锌,主要流程如下:
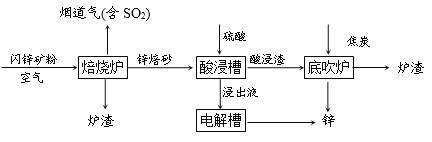
(1)焙烧炉中ZnS转化为ZnO,反应的化学方程式为:____________。
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的浸出液,反应过程中需不断搅拌,其目的是____________。酸浸渣的主要成分是铁酸锌(ZnFe2O4),其中铁元素的化合价为____________。
(3)底吹炉中可以获得锌,发生的反应主要有:
①3ZnFe2O4+ C![]() 2Fe3O4 +3ZnO+CO
2Fe3O4 +3ZnO+CO
②ZnFe2O4+ CO![]() 2FeO + ZnO+CO2
2FeO + ZnO+CO2
③ZnO+ CO![]() Zn(蒸汽)+CO2
Zn(蒸汽)+CO2
经分析,炉渣中除了Fe3O4、FeO等铁的氧化物外,还含有铁的单质,理由是______________
(4)烟道气中的二氧化硫用石灰石浆吸收以防止污染环境,并获得生产石膏的原料硫酸钙,其反应的化学方程式为2CaCO3+2SO2+O2=2CaSO4+2CO2。若1000 kg废气中含有1.6 kg二氧化硫,计算这些二氧化硫产生硫酸钙的质量。_______ (写出计算过程)
参考答案:
【答案】2ZnS+ 3O2![]() 2ZnO + 2SO2使硫酸与锌焙砂充分反应,提高转化率+3高温条件下,一氧化碳能与铁的氧化物反应生成铁单质解:设这些二氧化硫可以产生硫酸钙质量为x
2ZnO + 2SO2使硫酸与锌焙砂充分反应,提高转化率+3高温条件下,一氧化碳能与铁的氧化物反应生成铁单质解:设这些二氧化硫可以产生硫酸钙质量为x
2CaCO3+2SO2+O2=2CaSO4+2CO2
128 272
1.6kg x
![]()
x=3.4kg
答:这些二氧化硫可以产生3.4kg硫酸钙。
【解析】(1)焙烧炉中ZnS转化为ZnO,反应的化学方程式为:2ZnS+ 3O2高温2ZnO + 2SO2。
(2)酸浸槽中,硫酸与锌焙砂反应得到用于电解的浸出液,反应过程中需不断搅拌,其目的是使硫酸与锌焙砂接触更充分,进而充分反应,提高转化率。酸浸渣的主要成分是铁酸锌(ZnFe2O4),设其中铁元素的化合价为为x,则2x+(+2)+(-2)×4=0 x=+3;(3)炉渣中除了Fe3O4、FeO等铁的氧化物外,还含有铁的单质,理由是一氧化碳或碳在高温下能与铁的氧化物反应,生成单质铁;(4). 设这些二氧化硫可以产生硫酸钙质量为x
2CaCO3+2SO2+O2=2CaSO4+2CO2
128 272
1.6kg x
![]()
x=3.4kg
答:这些二氧化硫可以产生3.4kg硫酸钙。
-
科目: 来源: 题型:
查看答案和解析>>【题目】
【探究一】
小明依据呼出气体成分认为:吹的气流中有较多的 的气体,使蜡烛缺氧熄灭。小聪设计了以下实验方案: ,否定了小明的想法。从而认为蜡烛熄灭是因为吹的气流带走了 ,使温度降到了着火点以下。
【探究二】
小红依据灭火的原理经过进一步思考认为,也可能因为吹的气流移走了可燃物——蜡蒸气,使蜡烛熄灭。为此她查阅了相关资料并进行了以下两个实验:
查阅
资料:蜡烛的着火点大约是190℃,酒精灯火焰的温度在400℃-1000℃;蜡烛燃烧实际是石蜡蒸气在燃烧。
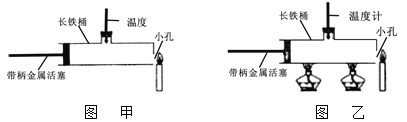
实验1:如图甲,把带柄金属活塞从左端位置迅速向右推,右端蜡烛火焰立即熄灭。
实验2:如图乙,先将带柄金属活塞放到左端位置,点燃酒精灯,当温度计的示数达到280℃以上时,点燃右面的蜡烛,把带柄金属活塞从左端位置迅速向右推出,右端蜡烛火焰立即熄灭。
【实验结论】蜡烛一吹就灭的原因 。
【实验分析、讨论】
(1) 实验2中用两盏酒精灯的目的是 。
(2)小红为验证自己的想法,做了实验1和实验2两个实验,主要是应用了科学探究方法中的 法。
【拓展应用】下列生产生活中灭火方式与上述实验灭火原理一致的是( )
A.消防用大功率风力灭火机灭火
B.用干冰灭火
C.用锅盖盖灭油锅着的火
D.用水灭火
-
科目: 来源: 题型:
查看答案和解析>>【题目】了解金属性质是合理利用金属资源的关键。请回答下列问题:
(1)将一片铝箔在空气中用酒精灯加热,观察到铝箔表面变暗,化学反应方程式为:____________,铝箔内部熔化但不滴落,这是由于____________。若将另一片同样大小的铝箔伸入到充满氧气的集气瓶中,引燃,观察到铝箔剧烈燃烧,发出耀眼白光,说明铝和氧气反应的剧烈程度与氧气的____________有关。
(2)为了验证铝、锌、铜三种金属的活动性顺序,下列四种方案中可行的是____________。
A.将铝、铜分别投入硫酸锌溶液 B.将锌、铜分别投入硫酸铝溶液
C.将锌分别投入硫酸铝、硫酸铜溶液 D.将铜分别投入硫酸铝、硫酸锌溶液
(3)已知久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3]。某同学对铜生锈条件进行探究,设计如下图所示四个实验。若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现。
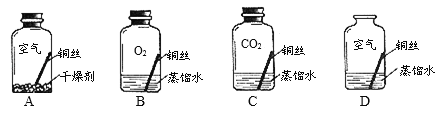
①实验C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是____________;
②B瓶与D瓶中的现象对比,可以得出的结论是__________;
③由上述四个实验可分析得出,铜生锈是铜与空气中的____________共同作用的结果。
-
科目: 来源: 题型:
查看答案和解析>>【题目】一定温度下,从100g20%的某溶液中取出10g,剩下的溶液溶质质量分数为( )
A. 20% B. 18% C. 10% D. 2%
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知:草酸钙(CaC2O4)比碳酸钙受热易分解,CaC2O4
 CaCO3+CO↑。将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法正确的是
CaCO3+CO↑。将12.8gCaC2O4固体加热一段时间后剩余7.8g固体。下列说法正确的是A. 剩余固体为纯净物
B. 剩余固体中含有钙元素的质量为4.0g
C. 将剩余固体溶于过量的稀盐酸,产生4.4g CO2
D. 加热产生的CO气体为5.0 g
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学上把“生成新物质的变化叫做化学变化”,下面对化学变化中“新物质”的解释正确的是
A.“新物质”就是自然界中不存在的物质
B.“新物质”就是与变化前的物质在颜色、状态等方面有所不同的物质
C.“新物质”就是与变化前的物质在元素组成上不同的物质
D.“新物质”就是在组成或结构上与变化前的物质不同的物质
-
科目: 来源: 题型:
查看答案和解析>>【题目】图示的四个图像分别对应四个变化过程的一种趋势,下列分析正确的是
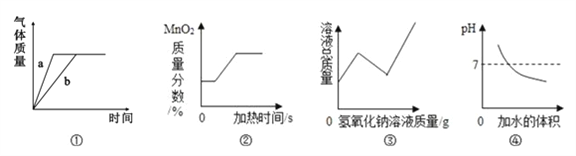
A. 甲图:可能是双氧水溶液制氧气,a未使用催化剂,b使用了催化剂
B. 乙图:可能是加热一定质量的氯酸钾和二氧化锰固体混合物制取氧气过程
C. 丙图:可能是硫酸铜溶液中滴加氢氧化钠溶液
D. 丁图:可能是向一定量的氢氧化钠溶液中加水稀释,溶液的pH变化
相关试题

