【题目】某同学进行下图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合,再次充分反应后过滤,结果得到滤渣A和无色滤液B。
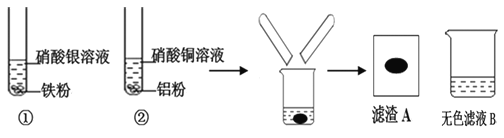
(1)试管①中反应的化学方程式为:_____________________ 。试管②中观察到的现象是:有红色固体析出,溶液________________。
(2)无色滤液B中含有的溶质为___________填化学式)
(3)设计实验探究滤渣A的成分
【提出问题】滤渣A的成分是什么?
【查阅资料】银、铜、铁、铝四种金属中,只有铝能与氢氧化钠溶液反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【提出猜想】滤渣A的成分为:
猜想一:银、铜 猜想二:银、铜、铁 猜想三:银、铜、铁、______.
【分析思考】猜想一______(填“是”或“否”)合理,理由是__________________
【进行实验】区两份滤渣A样品进行以下实验,请填写下列空白。
样品 | 加入试剂 | 实验现象 |
第一份样品 | 足量稀盐酸 | 产生气泡,固体部分溶解,溶液变为___________ |
第二份样品 | 足量氢氧化钠溶液 | 现象b |
【做出判断】①如果现象b为“产生气泡,固体部分溶解”,则猜想_____成立;
②如果现象b为“______________________”,则猜想_____成立;
参考答案:
【答案】 Fe+2AgNO3=Fe (NO3)2+2Ag 由蓝色变无色 Al(NO3)3 铝 否 由无色滤液可知,铁已被置换出来 浅绿色 三 无明显现象 二
【解析】本题通过金属与盐溶液的反应考查了金属活动性顺序的运用。根据用同种金属置换不同的盐溶液,盐中金属排在金属活动性顺序中较后的金属首先被置换出来和盐溶液的颜色进行分析。
(1)试管①中的反应是硝酸银与铁反应生成硝酸亚铁和银,化学方程式为:Fe+2AgNO3=Fe (NO3)2+2Ag;试管②中的反应是硝酸铜与铝反应生成硝酸铝和铜,观察到的现象是:有红色固体析出,溶液由蓝色变无色;
(2) 滤液B呈无色,说明溶液中无硝酸亚铁(呈浅绿色)、硝酸铜(呈蓝色),滤液B中含有的溶质为硝酸铝,化学式为:Al(NO3)3;
(3) 提出猜想:反应过程中铝可能过量,所以猜想三:银、铜、铁、铝;
分析思考:猜想一不合理,由无色滤液可知,铁已被置换出来;
进行实验:由无色滤液可知,铁已被置换出来,加入盐酸时,铁与盐酸反应生成浅绿色的硫酸亚铁和氢气,实验现象是:产生气泡,固体部分溶解,溶液变为浅绿色;
做出判断:①银、铜、铁、铝四种金属中,只有铝能与氢氧化钠溶液反应放出氢气。如果现象b为“产生气泡,固体部分溶解”,固体中存在铝,则猜想三成立;②如果现象b为“无明显现象”,固体中没有铝,则猜想二成立。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A-G是初中化学常见的物质,由氢、碳、氧、钙、铁中的一种或几种组成。已知A是一种红色固体,C是常见的金属,D有助燃性,A、B、E、F都是氧化物,G是含钙的化合物,物质之间的相互反应及转化关系如图所示,图中“→”表示转化关系,“ — ”表示能相互反应。 (部分反应物、生成物或反应条件已略去)。
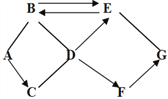
请回答下列问题
(1)分别写出物质E、G的化学式: _______ ________.
(2)写出C、D发生剧烈氧化时的现象 __________________
(3)写出A-B发生反应的化学方程式_________________________________
(4) 物质F可以是__________,也可以是 __________.
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室中有一桶含Fe2(SO4)3、FeSO4、CuSO4和H2SO4的废液。他们想从中回收铜并制取“还原铁粉” ,主要步骤如图所示。
查阅资料:Fe2(SO4)3 + Fe=3FeSO4 ,FeCO3
 FeO+CO2↑
FeO+CO2↑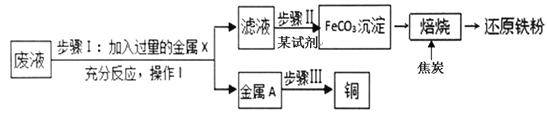
(1)金属X为_______,步骤I加入过量的金属X后发生了________个化学反应。
(2)金属A中的成分有______,步骤III可采用最简单的方法为 _____________________ 。
(3)在此流程中一定需要用到过滤操作的步骤是 ___________(填Ⅰ~Ⅲ)。
(4)FeCO3沉淀隔绝空气进行“焙烧”后,加入焦炭才能制得铁粉,写出加入焦炭后发生反应的化学方程式________________________________ 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的仪器,按要求回答问题:
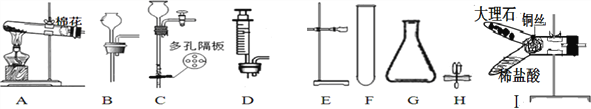
(1)仪器G的名称是________ , 可用于加热固体制取O2的发生装置为______(填字母),该装置中发生反应的化学方程式为 _________________.
(2)若用37.5%的过氧化氢溶液制取O2,最好选用DG组合成发生装置,理由是_________,若要将上述溶液稀释成60g、5%的溶液,则需要原溶液的质量为_______g.
(3)下图J装置可用于实验室制取CO2,检验该装置气密性的方法:从长玻璃管口加入一定量的水,然后用弹簧夹夹紧胶皮管,将左侧长玻璃管向上提起一段后静置,若观察到______________,则气密性良好。该装置在操作上具有的优点是_________________,若从B~H中选择 __________(填字母)进行组合,也能具有同样的优点。
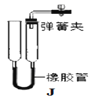
(4)上图I装置的Y型试管内装有制取CO2的药品, 反应的化学方程式为________, 可通过______________________的操作来制得CO2,该装置______(填“有”或“没有”)J装置的操作优点。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列标签为哈药集团生产的“新盖中盖牌”高钙片的部分文字,请回答:

(1)碳酸钙是由______种元素组成;
(2)碳酸钙中钙元素的质量分数为 ______ ;
(3)若要补钙1g,则要服用钙片________片。
(4)每片高钙片中碳酸钙的质量分数为_______;
-
科目: 来源: 题型:
查看答案和解析>>【题目】为测定铜锌合金中锌的质量分数,进行了以下实验;取40g铜锌合金放入烧杯中,称得烧杯及所盛铜锌合金的总质量为140g,再把120g盐酸平均分成四份依次加入烧杯中,每次充分反应后进行称量,实验数据如下:
所加盐酸的次数
第一次
第二次
第三次
第四次
烧杯及所盛物质的总质量/g
169.7
199.4
229.2
259.2
请你据此分析计算:
(1)第一次实验生成氢气的质量是 ________ g.
(2)利用第一次实验的数据,计算30g盐酸中溶质的质量分数________ (写出计算过程,精确到0.1%)
(3)实验最终结束后,同学们求出了合金中锌的质量分数=__________.
(4)下图表示所加盐酸的质量与反应后所得溶液质量的关系曲线,请写出A点(X=______ ,Y=______)的坐标。
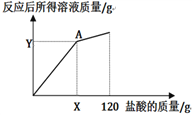
-
科目: 来源: 题型:
查看答案和解析>>【题目】规范的操作是实验成功的保证。下列实验操作正确的是
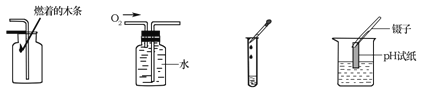
A.CO2验满 B.收集O2 C.滴加液体 D.测溶液pH
相关试题

