【题目】为测定铜锌合金中锌的质量分数,进行了以下实验;取40g铜锌合金放入烧杯中,称得烧杯及所盛铜锌合金的总质量为140g,再把120g盐酸平均分成四份依次加入烧杯中,每次充分反应后进行称量,实验数据如下:
所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
烧杯及所盛物质的总质量/g | 169.7 | 199.4 | 229.2 | 259.2 |
请你据此分析计算:
(1)第一次实验生成氢气的质量是 ________ g.
(2)利用第一次实验的数据,计算30g盐酸中溶质的质量分数________ (写出计算过程,精确到0.1%)
(3)实验最终结束后,同学们求出了合金中锌的质量分数=__________.
(4)下图表示所加盐酸的质量与反应后所得溶液质量的关系曲线,请写出A点(X=______ ,Y=______)的坐标。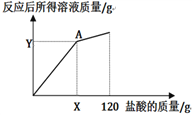
参考答案:
【答案】 0.3 36.5% 65% 80 105.2
【解析】本题考查了表格型计算题,质量分数和化学方程式的综合计算,处理数据时,当反应前后出现了质量差,要想到产生的气体。
(1)第一次实验生成氢气的质量=140g+30g-169.7g=0.3g;
(2)设:30克盐酸中所含HCl的质量为x。
Zn+2HCl=ZnCl2+H2↑
73 2
x 0.3g
![]() x=10.95g
x=10.95g
盐酸中溶质的质量分数=![]() ×100%=36.5%;
×100%=36.5%;
(3)实验最终结束后,产生的氢气质量=140g+120g-259.2g=0.8g;
设:生成0.8g的氢气需要锌的质量为y,HCl的质量为z。
Zn+2HCl=ZnCl2+H2↑
65 73 2
y z 0.8g
![]() y=26g
y=26g
合金中锌的质量分数=![]() ×100%=65%;
×100%=65%;
(4)根据关系曲线可知A点表示盐酸与锌恰好完全反应。
![]() z=29.2g,盐酸的质量=
z=29.2g,盐酸的质量=![]() =80g;反应后的溶液质量=26g+80g-0.8g=105.2g。所以A点坐标是(80,105.2)。
=80g;反应后的溶液质量=26g+80g-0.8g=105.2g。所以A点坐标是(80,105.2)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图是实验室制取气体的仪器,按要求回答问题:
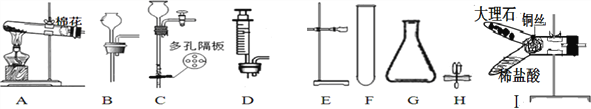
(1)仪器G的名称是________ , 可用于加热固体制取O2的发生装置为______(填字母),该装置中发生反应的化学方程式为 _________________.
(2)若用37.5%的过氧化氢溶液制取O2,最好选用DG组合成发生装置,理由是_________,若要将上述溶液稀释成60g、5%的溶液,则需要原溶液的质量为_______g.
(3)下图J装置可用于实验室制取CO2,检验该装置气密性的方法:从长玻璃管口加入一定量的水,然后用弹簧夹夹紧胶皮管,将左侧长玻璃管向上提起一段后静置,若观察到______________,则气密性良好。该装置在操作上具有的优点是_________________,若从B~H中选择 __________(填字母)进行组合,也能具有同样的优点。
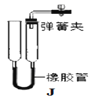
(4)上图I装置的Y型试管内装有制取CO2的药品, 反应的化学方程式为________, 可通过______________________的操作来制得CO2,该装置______(填“有”或“没有”)J装置的操作优点。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学进行下图实验,充分反应后,将试管①②内的物质倒入同一烧杯中混合,再次充分反应后过滤,结果得到滤渣A和无色滤液B。
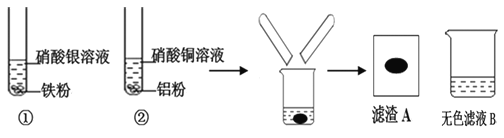
(1)试管①中反应的化学方程式为:_____________________ 。试管②中观察到的现象是:有红色固体析出,溶液________________。
(2)无色滤液B中含有的溶质为___________填化学式)
(3)设计实验探究滤渣A的成分
【提出问题】滤渣A的成分是什么?
【查阅资料】银、铜、铁、铝四种金属中,只有铝能与氢氧化钠溶液反应,反应方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑
【提出猜想】滤渣A的成分为:
猜想一:银、铜 猜想二:银、铜、铁 猜想三:银、铜、铁、______.
【分析思考】猜想一______(填“是”或“否”)合理,理由是__________________
【进行实验】区两份滤渣A样品进行以下实验,请填写下列空白。
样品
加入试剂
实验现象
第一份样品
足量稀盐酸
产生气泡,固体部分溶解,溶液变为___________
第二份样品
足量氢氧化钠溶液
现象b
【做出判断】①如果现象b为“产生气泡,固体部分溶解”,则猜想_____成立;
②如果现象b为“______________________”,则猜想_____成立;
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列标签为哈药集团生产的“新盖中盖牌”高钙片的部分文字,请回答:

(1)碳酸钙是由______种元素组成;
(2)碳酸钙中钙元素的质量分数为 ______ ;
(3)若要补钙1g,则要服用钙片________片。
(4)每片高钙片中碳酸钙的质量分数为_______;
-
科目: 来源: 题型:
查看答案和解析>>【题目】规范的操作是实验成功的保证。下列实验操作正确的是
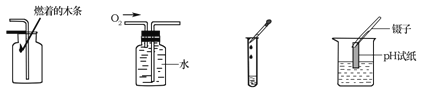
A.CO2验满 B.收集O2 C.滴加液体 D.测溶液pH
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图像不能正确反映其对应变化关系的是
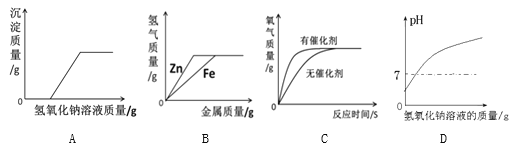
A.向一定质量的硫酸铜和稀硫酸的混合溶液中逐滴加入氢氧化钠溶液
B.向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉
C.用等质量、等溶液的过氧化氢溶液在有无催化剂条件下制氧气
D.一定质量稀盐酸中逐滴加入氢氧化钠溶液
-
科目: 来源: 题型:
查看答案和解析>>【题目】在化学反应中,物质所含元素的化合价发生了变化的反应就是氧化还原反应. 例:2Na+Cl2=2NaCl,反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应.
(1)根据化合价是否变化分析,下列反应不属于氧化还原反应的是(填序号)______.
A.2Mg+O2
 2MgO;B.CaO+H2O=Ca(OH)2 ;C.2KClO3
2MgO;B.CaO+H2O=Ca(OH)2 ;C.2KClO3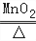 2KCl+3O2↑D.H2+CuO
2KCl+3O2↑D.H2+CuO Cu+H2O
Cu+H2O(2)含有高价态的化合物,通常具有氧化性,如在氯化铁溶液中,氯化铁能将单质铜氧化成氯化铜,自身被还原成氯化亚铁.试回答:
①该反应的化学方程式可表示为______________.
②向上述反应后的溶液中加入适量的锌粉反应后过滤,向过滤后得到的固体物质上加稀盐酸有气泡产生,则滤纸上一定含有的固体是(写化学式)________.
相关试题

