【题目】某化学兴趣小组在探究稀盐酸的化学性质时,做了如图一所示的三个实验。
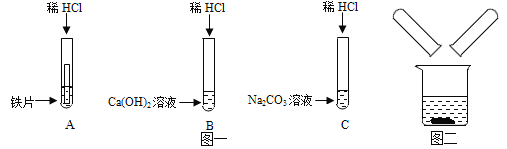
(1)写出实验A中的反应现象_____。
(2)实验结束后,小组同学将B、C两支试管中的废液同时倒入一个清净的烧杯中(如图二所示)观察到先有气泡产生,后有白色沉淀生成。同学们将烧杯内的物质进行过滤,对所得滤液的溶质成分进行探究。
写出上述生成白色沉淀的化学反应方程式_____。
(提出猜想)
甲同学猜想:NaCl;
乙同学猜想:NaCl、CaCl2;
丙同学猜想:NaCl、CaCl2、HCl;
你的猜想:_____。
(交流讨论)你认为_____同学的猜想一定不正确,理由是_____。
(设计实验)请设计实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取少量滤液于试管中,向其中滴加_____ | _____ | 猜想成立 |
参考答案:
【答案】产生气泡、溶液由无色逐渐变为浅绿色 CaCl2+Na2CO3═CaCO3↓+2NaCl NaCl、Na2CO3 丙有白色沉淀产生、滤液中不可能含有HCl CaCl2溶液有白色沉淀产生
【解析】
(1)由于铁与稀盐酸的反应生成了氯化亚铁和氢气,所以A试管中的反应现象铁片表面有气泡产生,溶液由无色逐渐变为浅绿色。发生反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;
(2)在试管中氯化钙与碳酸钠反应生成了碳酸钙和氯化钠,反应的化学方程式是:CaCl2+Na2CO3═CaCO3↓+2NaCl;【提出猜想】由上述分析可知,当碳酸钠与盐酸、氯化钙恰好反应时,滤液中只含有氯化钠;当氯化钙有剩余时,滤液中含有氯化钠和氯化钙,当碳酸钠剩余时,滤液中含有氯化钠和碳酸钠。所以你的猜想是:NaCl、Na2CO3;【交流讨论】由于白色沉淀是CaCO3,能与盐酸反应,二者不能共存,所以丙同学猜想不成立;【设计实验】取少量滤液于试管中,向其中滴加氯化钙,有白色沉淀产生。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图为实验室制取气体的常用装置。据图回答下列问题:
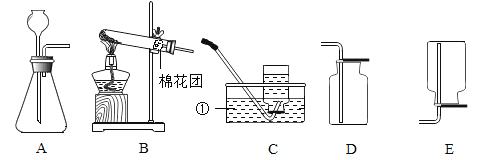
(1)仪器①的名称是_____。
(2)用B为发生装置制取氧气的化学方程式为_____。试管口稍向下倾斜的目的是_____。
(3)既能收集氧气也能收集二氧化碳气体的装置是_____(填序号)。 用该装置收集二氧化碳,检验二氧化碳气体是否收集满的方法是_____。
(4)实验室常用块状硫化亚铁固体和稀疏酸在常温下反应制取硫化氢气体,实验室制取硫化氢气体可选用的发生装置是_____,理由是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】水和溶液对人类的生产。生活具有重要意义。
(1)使用硬水会给生活带来许多麻烦,如_____ (写出一点即可);生活中常用煮沸的方法降低水的硬度,实验室中则用_____的方法降低水的硬度。
(2)水是重要的氧化物,电解水实验说明水是由_____组成,水通电分解的过程中一定不变的微粒是_____。
(3)配制溶质质量分数为3%的氯化钠溶液时,可用溶质质量分数为6%的氯化钠溶液和水配制,若量取溶质质量分数为6%的氯化钠溶液时俯视读数,其他操作均正确,则配制的溶液中溶质质量分数_____3%(填“>”、“<”、“=”)。
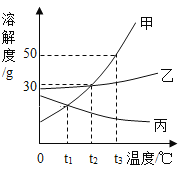
(4)如图为甲、乙、丙三种物质在水中的溶解度曲线。请根据图示回答:①t2℃时,向盛有50g水的烧杯中加入20g甲物质,充分溶解后,所得溶液质量为_____g,将烧杯中物质升温到t3℃时,所得溶液中溶质和溶液的质量比为_____。
②t3℃时,把等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液质量由大到小的顺序为_____;
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A﹣H均为初中化学常见的物质。其中A、C组成元素相同,且常温下是气体,B为红棕色粉末,H是紫红色金属,G是白色难溶固体,相对分子质量为100.他们的相互转化关系如图(图中反应条件均已略去)。请回答下列问题:
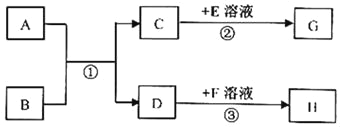
(1)F溶液中一定含有的离子是_____。
(2)写出反应①的化学方程式_____。
(3)反应③的基本反应类型是_____。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某纯碱样品中含有少量NaCl,为测定其中碳酸钠的含量,某实验小组的同学取该样品12.6g加入到一定质量的稀盐酸中,恰好完全反应,生成气体4.4g,得到137g氯化钠溶液。
计算:
(1)原固体混合物中碳酸钠的质量分数。
(2)得到137g氯化钠溶液中溶质的质量分数。
(提示:相关反应为:Na2CO3+2HCl=2NaCl+H2O+CO2↑)
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列实验操作中正确的是( )
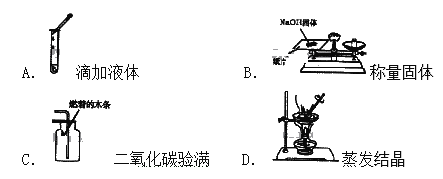
A. A B. B C. C D. D
-
科目: 来源: 题型:
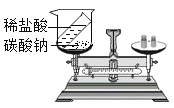
查看答案和解析>>【题目】下列实验设计不能达到其对应实验目的的是( )
A.
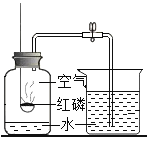 测定空气里氧气的含量 B.
测定空气里氧气的含量 B. 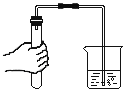 检查装置的气密性
检查装置的气密性C.
 验证质量守恒定律 D.
验证质量守恒定律 D.  证明CO2密度比空气的大
证明CO2密度比空气的大
相关试题

