【题目】实验是化学的灵魂,请你和同学们一起完成下列实验。
(1)用浓盐酸(溶质质量分数为37%,密度为1.14g/mL)配制200g10%稀盐酸,在配制过程中,除了烧杯外,还需要用到的仪器有___________(填序号)。
①量筒 ②药匙 ③试管 ④酒精灯 ⑤滴管 ⑥玻璃棒
某同学量取浓盐酸时平视读数,量取水时仰视读数,则所配得的稀硫酸溶质质量分数________10%(填“>”、“=”、“<”)
(2)根据下列装置图,回答有关问题:
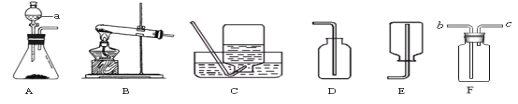
①指出上图中仪器a的名称是_________________;
②实验室用锌粒和稀盐酸制取并收集一瓶氢气,在上述仪器A~E中选择连接一套实验装置,应选择的装置组合是________,欲制得较为纯净的氢气,可在收集装置前先连接装有__________溶液的F装置除去氯化氢气体,气体应从F装置的________(填b或c)管口进入。
③用氯酸钾和二氧化锰制取氧气的化学方程式为_____________,若用装满水的F装置收集氧气,则应将气体从________(填b或c)管口进入。
参考答案:
【答案】①⑤⑥ < 分液漏斗 AC或AE 氢氧化钠 b 2KClO3![]() 2KCl+3O2↑ c
2KCl+3O2↑ c
【解析】
(1)盐酸稀释时,首先计算配制溶液所需浓盐酸和水的质量,换算成体积,再量取浓盐酸和水,最后进行溶解;在这些操作中需要的仪器:量筒、胶头滴管、烧杯和玻璃棒;量取浓盐酸时平视读数,量取水时仰视读数,仰视时所读取的数据小于所量水的实际体积,即量取水的体积大于实际所需水的量。由于溶质的质量一定,可判断如此操作所配溶液溶质的质量分数比实际的偏小;
(2)①据图可知仪器a是分液漏斗;
②锌粒与稀盐酸反应制取氢气属于固液常温型,选择装置A来制取,氢气的密度比空气小,不易溶于水,所以可用向下排空气法和排水法来收集;欲制得纯净的氢气,可在收集装置前先连接装有NaOH溶液的F装置除去氯化氢气体,氢气从长管进入;
③氯酸钾在二氧化锰的催化作用下、加热生成氯化钾和氧气,其化学方程式为2KClO3![]() 2KCl+3O2↑;氧气的密度比水小且不易溶于水,所以用装满水的F装置收集氧气,则应将气体从c管口进入。
2KCl+3O2↑;氧气的密度比水小且不易溶于水,所以用装满水的F装置收集氧气,则应将气体从c管口进入。
-
科目: 来源: 题型:
查看答案和解析>>【题目】如图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是
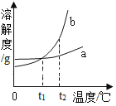
A. t1℃时,a、b两物质溶解度相等
B. 将t2℃时b溶液降温至t1℃,一定有固体析出
C. 若b中混有少量的a,可用蒸发结晶的方法提纯b
D. t2℃时,b溶液的溶质质量分数一定大于a溶液的溶质质量分数
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列四个图像分别对应四个变化过程,其中不正确的是
A.
 电解水
电解水B.
 向一定量的氢氧化钡溶液中不断加入稀硫酸
向一定量的氢氧化钡溶液中不断加入稀硫酸C.
 向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸D.
 表示向一定量的氢氧化钠和碳酸钠的混合溶液中,逐滴加入过量的稀盐酸溶液
表示向一定量的氢氧化钠和碳酸钠的混合溶液中,逐滴加入过量的稀盐酸溶液 -
科目: 来源: 题型:
查看答案和解析>>【题目】敏敏通过查找资料得知:大多数碳酸盐难溶于水。但雨水、河水中溶有CO2后,就会与土壤、岩石中的CaCO3等反应生成可溶性的碳酸氢盐进入水中,从而提高了水的硬度,即: CaCO3+H2O+CO2 === Ca(HCO3)2 ,这些可溶性的碳酸氢盐,加热时又易分解为CaCO3等难溶物质而形成水垢,如Ca(HCO3)2
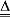 CaCO3↓ +H2O+CO2↑。绝大多数碳酸盐都具有类似的性质。请你结合所学知识分析,下列说法中不正确的是
CaCO3↓ +H2O+CO2↑。绝大多数碳酸盐都具有类似的性质。请你结合所学知识分析,下列说法中不正确的是A. 除去CO2中的HCl气体,可以用碳酸钠溶液。
B. 向澄清的石灰水中不断地通入CO2,刚开始有白色沉淀,继续通一段时间后,沉淀消失。
C. 可用加热的方法除去碳酸钠固体中混有的少量碳酸氢钠,该反应的化学方程式可以表示为NaHCO3
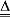 Na2CO3 +H2O+CO2↑。
Na2CO3 +H2O+CO2↑。D. 已知相同条件下,碳酸氢钠的溶解度远小于碳酸钠的溶解度。在一定温度下,向一定量的饱和碳酸钠溶液中通入足量的CO2,会有固体析出。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列图中字母A﹣I分别表示初中化学常见的物质,其中C是能使澄清石灰水变浑浊的气体,B是一种黑色固体;H是一种无色无味的气体,“
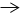 ”表示物质间存在转化关系,图中部分反应物、生成物和反应条件已略去。
”表示物质间存在转化关系,图中部分反应物、生成物和反应条件已略去。
请回答:
(1)写出下列物质的化学式:A______;
(2)写出反应的化学反应方程式
①_______________, ②__________;
(3)写出G+F→I的化学反应方程式________,基本反应类型属于______反应。
(4)关于气体C:若C可以供给呼吸,则自然界中可通过________来实现C
 H的转化;若C为一种有毒气体,常用于工业炼铁,请写出一个工业炼铁原理的化学方程式__________。
H的转化;若C为一种有毒气体,常用于工业炼铁,请写出一个工业炼铁原理的化学方程式__________。 -
科目: 来源: 题型:
查看答案和解析>>【题目】学习了酸与碱的化学性质后,兴趣小组的同学利用实验室的一瓶氢氧化钠溶液进行如下探究。
探究Ⅰ(提出问题) 该氢氧化钠溶液是否已经变质?
氢氧化钠露置于空气中变质的反应方程式_________,___(填“是”或“不是”)复分解反应。
(实验探究)
实验操作
实验现象
实验结论
方法1:取样,滴加足量的______,
无气体产生
氢氧化钠溶液没有变质
方法2:取样,滴加氢氧化钙溶液
(实验结论)氢氧化钠溶液没有变质。
探究Ⅱ(提出问题) 中和反应过程中是否有能量变化?
(实验探究)
甲同学:取适量该氢氧化钠溶液,滴加1~2滴酚酞,在溶液中插入温度计,再逐滴加入稀盐酸,边滴加边搅拌,测得温度变化情况如图所示。
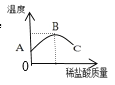
①写出该反应的化学方程式___________,实验中搅拌的目的是____________;
②从图像可知,中和反应是____过程;请解释BC段的成因__________。
乙同学:取少量氢氧化钠固体与稀盐酸反应进行实验,得出了同样的结论。小华同学认为,乙同学的结论不可信,你认为她的理由是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫酸的用途极广,常用于生产化肥、冶炼金属等。工业制硫酸的流程:

(1)①工业制H2SO4可能会引起的环境问题是_______。
②用小木棍蘸少量浓硫酸,放置一会儿后,可观察到蘸有浓硫酸的部位变黑,这是因为浓硫酸具有__________。
(2)某工厂用一定质量分数的稀硫酸处理含Ba(OH)2的残液,变化关系如图。
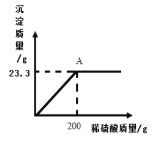
①A点液体的pH_____7(填“大于”、“等于”或“小于”不考虑其它影响);
②所用稀硫酸的溶质质量分数为多少_____?(写出计算过程)
相关试题

