【题目】(1)金属钠化学性质非常活泼,常温下即可与氧气反应。
(提出问题)常温下钠与氧气反应的产物是什么?
已知:钠的氧化物有氧化钠(Na2O)和过氧化钠(Na2O2),钠的氧化物都能与水反应。其中 Na2O 与水反应的化学方程式为:Na2O+H2O=2NaOH;
Na2O2 与水反应生成氢氧化钠和氧气,其化学方程式为_________。
(做出猜想)常温下钠与氧气反应的产物可能为:
猜想一:______;猜想二:Na2O2;猜想三:Na2O2 和 Na2O。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量上述钠的氧化物, 加入适量的蒸馏水 | ______ | 猜想一正确 |
(反思拓展)①实验结束后,废液缸中的溶液呈碱性,请你设计一个实验方案处理废液。
②也可以用盐酸区别 Na2O2 和 Na2O,Na2O2 与稀盐酸反应氯化钠、水和氧气,其化学方程式为______。
(继续探究)钠在空气中放置较长时间,发生反应生成的白色固体是什么?
(做出猜想)生成的白色固体可能是:①Na2CO3 ②Na2CO3 和 NaOH
(实验探究二)请你自行设计方案进行探究,并写出实验的现象、步骤和结论__________。
(2)小苏打常用作焙制糕点的发酵剂,其受热会分解生成碳酸钠、水和二氧化碳。为测定某小苏打样品的纯度,现取 10 g 样品加热到质量不再减少为止(杂质不参加反应),共收集到二氧化碳 2.2 g,求样品中小苏打的质量分数__________。
参考答案:
【答案】2Na2O2+2H2O=4NaOH+O2↑Na2O固体溶于水,无气泡冒出加入适量的盐酸,将废液的 pH 调为 7 2Na2O2+4HCl=4NaCl+2H2O+O2↑取少量白色固体溶于水,加入足量的 CaCl2 溶液,过滤, 向滤液中滴加无色酚酞溶液,若溶液变红,则白色固体为 Na2CO3 和NaOH,若溶液不变红,则白色固体为 Na2CO3。84%
【解析】
(1)Na2O2 与水反应生成氢氧化钠和氧气,其化学方程式为2Na2O2+2H2O=4NaOH+O2↑;常温下钠与氧气反应的产物可能为Na2O、或者Na2O2 或者Na2O和Na2O2的混合物;氧化钠与水反应没有气体生成,故现象为固体溶解,没有气体生成,说明是氧化钠,故猜想一正确;废液显碱性,可以向废液中加入稀盐酸,调整pH至7即可;Na2O2 与稀盐酸反应氯化钠、水和氧气,反应方程式为2Na2O2+4HCl=4NaCl+2H2O+O2↑;碳酸钠可以与中性的氯化钙溶液反应生成碳酸钙沉淀和水,而氢氧化钠不能与氯化钙反应,故加入足量的氯化钙溶液,后过滤,在加入酚酞试剂,如不变红,说明产物是碳酸钠,如变红,说明产物是碳酸钠和氢氧化钠的混合物,故设计的实验方案为取少量白色固体溶于水,加入足量的 CaCl2 溶液,过滤, 向滤液中滴加无色酚酞溶液,若溶液变红,则白色固体为 Na2CO3 和NaOH,若溶液不变红,则白色固体为 Na2CO3。
(2)设生成2.2g的二氧化碳气体需要碳酸氢钠的质量为x
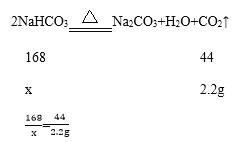
x=8.4g
样品中碳酸氢钠的质量分数为![]() ×100%=84%
×100%=84%
答:样品中小苏打的质量分数为84%,
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为氯化钠、碳酸钠(俗称纯碱)在水中的溶解度曲线。
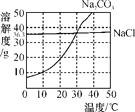
(1)当温度为30 ℃时,两种物质的溶解度有什么关系?_____________________
(2)生活在盐湖附近的人们习惯“夏天晒盐,冬天捞碱”。请你解释其原因。_____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C三种物质之间有如下图所示的转化关系(部分物质和反应条件已经略去)。
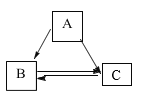
(1)若三种物质均有地壳中含量最多的元素,且C为单质,则A转化为B的化学方程式为______。
(2)若三种物质均含形成化合物种类最多的元素:
①假设A为单质,则C的化学式为______。
②假设C是难溶性盐,且其相对分子质量为100,则A的化学式为______, C转化为B的化学方程式为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学小组的同学利用 CuSO4、FeSO4 的混合溶液进行如下探究实验。
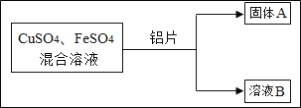
(1)写出铝与硫酸铜溶液反应的化学方程式_______________。
(2)向固体 A 上滴加稀盐酸,若有气泡产生,则 A 中一定含有的固体有哪些_____________?
若无气泡产生,则溶液 B 中一定含有的溶质有哪些___________________?
(3)实验时,某同学将铝片放入混合溶液中,发现一种无色无味气体产生的“异常”现象。他猜想该气体可能为 H2、CO2 或 SO2。请分别说明不可能是 CO2 和 SO2 的原因___________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图中 A、B、C、D 是四种粒子的结构示意图,请回答下列问题

(1)以上四种粒子的结构示意图中,属于同种元素的粒子是 _______(填字母代号)。
(2)以上四种粒子中,能得到电子的是 _____(填字母代号),属于稳定结构的是 ______(填字母代号)。
(3)D 元素的名称是 __________。
(4)写出地壳中含量最多的金属元素和图 C 表示的元素形成化合物的化学式 ______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】用红磷燃烧测定空气中氧气含量(装置如图)。
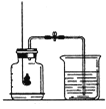
(1)红磷燃烧的化学方程式 ____________________;
(2)实验中要用过量的红磷,目的是 _________________;
(3)造成实验结果出现明显偏差的原因有 _________(填序号).
A.装置漏气 B.红磷较多 C.没有冷却就打开弹簧夹 D.燃着的红磷缓慢的伸入集气瓶
(4)由实验可得出的结论是 _____________。
(5)若将红磷换成硫粉,该实验能否获得成功?理由是 _________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室制取气体常常用到下列装置,根据给出的装置回答下列问题:
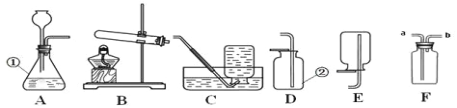
(1)写出标号仪器的名称:① ____________; ② _____________。
(2)若用 C 装置来收集氧气的依据是 ___________________,并检验O2是否已经集满的方法是 _________________,若用 F 装置来收集氧气,则气体由 _____________(a 或 b)口进入。
(3)若用 C 装置来收集完氧气,发现气体不纯,原因是 _____________________________。
(4)A 装置中的一处错误是 _______________________________________。
(5)若选择高锰酸钾制取并收集较纯净的 O2,则应选择的装置 _______________,该套装置有一处不足的地方,请你指出并加以改造:__________________________________。
(6)实验室还可以用分解过氧化氢溶液的方法制取氧气,常温下,在试管中分别加入下列物质,把带火星的木条伸入试管,不能使木条复燃的是 _________________。
A.5ml5%的过氧化氢溶液 B.5ml5%的过氧化氢溶液和少量二氧化锰
C.5ml5%的过氧化氢溶液和少量硫酸铜溶液 D.5ml5%的过氧化氢溶液和少量红砖粉末
(7)下图表示铁丝在氧气中燃烧示意图,写出该化学反应化学反应方程式 _________________________;
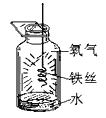
其中集气瓶底部放少量水的原因 ________________________________。
(8)实验室用锌粒和稀硫酸制取氢气,氢气的制取装置是 ___________________________。
相关试题

