【题目】某兴趣小组同学对实验室制氧气的条件进行如下探究:
(a)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
①将3.0g氯酸钾和1.0g二氧化锰均匀混合加热;
②将xg氯酸钾和1.0g氧化铜均匀混合加热。
在相同温度下,比较两组实验产生氧气的快慢。
①中反应的化学方程式是__________________________;②中x的值应为_____。
(猜想)除二氧化锰,氧化铜外,Fe2O3也可以做氯酸钾分解的催化剂。
按下表进行实验:测定分解温度(分解温度越低,催化效果越好)
实验编号 | 实验药品 | 分解温度/℃ |
① | 氯酸钾 | 580 |
② | 氯酸钾、二氧化锰(质量比1∶1) | 350 |
③ | 氯酸钾、氧化铜(质量比1∶1) | 370 |
④ | 氯酸钾、Fe2O3(质量比1∶1) | 390 |
由实验________与实验④对比,证明猜想合理。实验所用的三种金属氧化物,催化效果最好的是___。
(b)乙探究了影响过氧化氢溶液分解速率的某种因素。实验记录如下:
过氧化氢溶液的质量 | 过氧化氢的浓度 | 二氧化锰的质量 | 相同时间内产生VO2 | |
① | 50.0g | 1% | 0.1g | 9mL |
② | 50.0g | 2% | 0.1g | 16mL |
③ | 50.0g | 4% | 0.1g | 31mL |
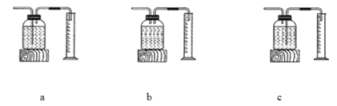
实验结论:在相同条件下,_______________________________,过氧化氢分解得越快。本实验中测量O2体积的装置(如图)应该选择:_______。(填字母)
参考答案:
【答案】2KClO3![]() 2KCl + 3O2↑ 3.0 ① 二氧化锰 过氧化氢的浓度越大,分解速率越快 c
2KCl + 3O2↑ 3.0 ① 二氧化锰 过氧化氢的浓度越大,分解速率越快 c
【解析】
(1)氯酸钾在二氧化锰作催化剂的条件下加热反应生成氯化钾和氧气,反应的化学方程式为:2KClO3![]() 2KCl + 3O2↑。
2KCl + 3O2↑。
(2)根据探究催化剂的种类对氯酸钾分解速率的影响应该控制其它条件相同,而催化剂的种类不同,所以②中x的值应为3.0。由实验①与实验④对比可知,Fe2O3也可以做氯酸钾分解的催化剂。实验所用的三种金属氧化物,催化效果最好的是二氧化锰。
(3)由实验数据可知,在相同的条件下,过氧化氢的浓度越大,分解速率越快。本实验装置必须保证排出水的导管应接近集气瓶的底部,由于氧气的密度比水的密度小,故氧气应该有短管通入,故选c。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某化学课外小组的同学,在实验室实验时发现一瓶标签破损的无色溶液(如下图所示)。
这瓶溶液是什么物质?在老师的指导下,同学们首先提出假设可能是实验室制备氧气的一种液体药品并进行了如下的探究活动。请在空白处完成相应内容。
[设计实验] 在试管中取少量黑色粉末二氧化锰,向其中滴入该无色溶液,立即产生大量气泡,并放出大量的热。
(1)用_________法收集一试管纯净的气体。
(2)反应的化学方程式为 ____________。
(3)检验收集的气体的方法为____________。
[实验现象]木条复燃。
[实验结论]由以上现象可知此气体是_____;该无色溶液是________,则原假设成立。
-
科目: 来源: 题型:
查看答案和解析>>【题目】实验室使用下列装置制取氧气
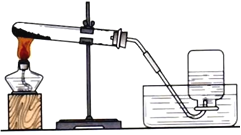
(1)如果使用高锰酸钾制取氧气,还必需使用的用品是___________________;
(2)加热固体,没有气泡产生的原因是__________________;
(3)以上使用的仪器重新组装,还能进行用过氧化氢溶液和二氧化锰制取氧气的实验, 这些仪器中,一定不需要使用的仪器是________________;
(4)实验室用过氧化氢溶液制取氧气的化学反应方程式为:_____________;
-
科目: 来源: 题型:
查看答案和解析>>【题目】在用白磷(白磷与红磷组成相同,着火点为40℃)探究质量守恒定律的实验中,晓涵同学将橡皮塞上的细玻璃管下端放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并引燃白磷,实验过程如下图所示。请回答下列问题:
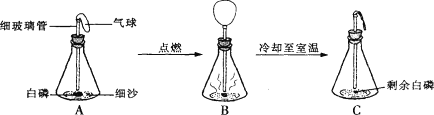
(1)此实验能否不用气球,改为直接用橡皮塞使锥形瓶密封?且说明理由____________
(2)实验中观察到气球先变大后变小,用理化知识解释产生此现象的原因是____________
(3)该同学联想到以前测定氧气体积分数时也用到红磷,且当时红磷必须过量,请解释原因。________。经过分析该同学认为上述探究质量守恒定律的实验中红磷也应过量,你认为她的观点正确吗?并加以解释____________________
(4)上述探究质量守恒定律的实验后,该同学为了验证锥形瓶内是否还有氧气剩余,用如下方法:打开瓶塞,用燃着的木条伸入锥形瓶,发现木条继续燃烧,说明瓶内还有少量氧气剩余。请你评价其实验方法正确与否,并解释:____________________
-
科目: 来源: 题型:
查看答案和解析>>【题目】木炭与氧化铜反应的化学反应方程式如下:2CuO+C
 2Cu+CO2↑
2Cu+CO2↑(1)该反应中,具有还原性的物质是________________________;
(2)实验过程中,观察固体发生的现象是_________________________;
(3)该实验如何检验有二氧化碳生成___________________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于下列物质的转化过程:H2→H2O,CO→CO2,C→CO2,说法错误是 ( )
A. 都能通过化合反应实现 B. 都必须通过和单质的反应实现
C. 都能通过氧化反应实现 D. 变化前后都有元素化合价改变
-
科目: 来源: 题型:
查看答案和解析>>【题目】模型是联系宏观与微观的桥梁。
(1)如图是钠原子结构示意图。

①X的数值为_________________。
②“11”指的是_________________。
③钠原子在化学反应中易失去1个电子,形成_______(填离子符号)。
(2)下图是氢分子和氧分子运动的示意图。

①在A、B和C中,能比较得出“温度越高,分子运动速率越快”的是__________(填标号)。
②从图中可见,影响分子运动速率的因素除温度外,还与______________________有关。
③举一个能说明“温度升高,分子运动速率加快”的生活事例:___________________________。
相关试题

