【题目】某班同学在做《基础实验8》中碱的化学性质时,发现将NaOH固体溶于水后的溶液与CuS04溶液反应时出现了三种实验现象:蓝色絮状沉淀、浅绿色沉淀、亮蓝色溶液。产生蓝色絮状沉淀时的反应方程式为_______________________________________。对于异常实验现象,
同学们展开研究性学习。
【提出问题】实验中产生异常现象的原因是什么?
【初步探究】甲同学将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中。实验现象如下:
滴加CuSO4溶液的量 | 实验现象 |
第1~6滴 | 产生蓝色沉淀,振荡后沉淀消失,形成亮蓝色溶液。 |
第7~9滴 | 产生蓝色沉淀,振荡后沉淀不消失,沉淀逐渐增多。 |
第10~20滴 | 蓝色沉淀不再增加,振荡后沉淀逐渐变为浅绿色。 |
【实验结论】_____________________________是实验出现“异常”的主要因素。
【再次探究】两种异常现象产物是什么?
【查阅资料】
①碱式硫酸铜是一种浅绿色固体,化学式可表示为aCuSO4·bCu(OH)2难溶于水,在酸溶液中可发生反应生成Cu2+、SO42—和H2O。加热时能分解生成氧化铜、非金属氧化物和氧气。
②铜酸钠[Na2Cu(OH)4]能溶于水,溶液呈亮蓝色。该溶液不稳定,久置或加热易生成氧化铜沉淀。
③碱式硫酸铜、氢氧化铜、铜酸钠之间可逐步转化。
【猜想假设】
Ⅰ.Cu(OH)2在NaOH溶液中溶解生成铜酸钠。
Ⅱ.实验中形成浅绿色沉淀是碱式硫酸铜。
【实验探究】
Ⅰ.乙同学向Cu(OH)2中加入过量饱和NaOH溶液,沉淀溶解,滴加少量稀硫酸,出现黑色沉淀。
Ⅱ.丙同学取出实验中浅绿色固体,分成等质量两份,一份高温灼烧后只得到1.6gCuO固体,另一份滴加10%的稀盐酸至恰好完全反应,共用去盐酸10.95g。
【结论解释】猜想Ⅰ成立。出现黑色沉淀原因是________________________________。
猜想II成立。a:b=________________。
【实验反思】丁同学按照书本要求向2mLCuSO4溶液中逐滴加入稀氢氧化钠溶液,始终未形成亮蓝色溶液,说明实验现象还与______________________有关,实验时要遵守实验要求。
参考答案:
【答案】 CuSO4+2NaOH==Cu(OH)2↓+Na2SO4 反应物的量 中和反应放热使铜酸钠分解成氧化铜 1:3 反应物浓度
【解析】氢氧化钠和硫酸铜反应生成硫酸钠和氢氧化铜,化学方程式为:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
【实验结论】实验中可知,随着硫酸铜加入的量的增加,产生不同的现象,所以反应物的量是实验出现“异常”的主要因素。
【结论解释】由于中和反应是放热的,中和反应放热使铜酸钠分解成氧化铜,所以出现黑色沉淀。
根据质量守恒,碱式硫酸铜中的铜的质量为氧化铜中的铜的质量,铜元素的质量为1.60g×![]() =1.28g;
=1.28g;
设碱式硫酸铜中的氢氧化铜中铜元素的质量x
碱式硫酸铜中的氢氧化铜与盐酸反应,根据化学方程式可得
Cu(OH)2~2HCl~Cu
73 64
10.95g×10% x
![]()
x=0.96g
所以碱式硫酸铜中的硫酸铜中铜元素的质量1.28g-0.96g=0.32g
则a:b=![]() =1:3;
=1:3;
【实验反思】由于反应物的浓度不同,所以反应的现象也不同。
-
科目: 来源: 题型:
查看答案和解析>>【题目】将X、Y两种金属片分别插人硫酸铜溶液中,X没有发生明显变化,Y表面析出金属铜。据此判断这三种金属的活动性由强到弱的顺序( )
A. Y、铜、X B. X、铜、Y C. 铜、Y、X D. Y、X、铜
-
科目: 来源: 题型:
查看答案和解析>>【题目】如右图为市售浓盐酸的部分标签内容,多次打开瓶盖倒出部分盐酸后,不能精确表示剩余盐酸信息的数字是( )

A. 500mL B. 1.19g/cm3 C. 36.5 D. 37%
-
科目: 来源: 题型:
查看答案和解析>>【题目】多角度认识物质变化,有助于我们更好地理解化学知识。
如图是自然界中的转化过程,回答下列问题。

(1)从物质分类的角度看,图中物质属于有机物的是纤维素、_________________;
(2)从物质转化的角度看,图中方框所示变化的化学方程式为____________________;
(3)从能量转化的角度看,木柴燃烧过程中是化学能转化为__________能;
(4)从物质循环的角度看,体现了自然界中的重要物质循环,图中参与循环的元素有_______种。
-
科目: 来源: 题型:
查看答案和解析>>【题目】除去CO中混有的少量CO2,应把混合气体通过
A、少量的水 B、灼热的氧化铜 C、澄清的石灰水 D、点燃
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学是一门以实验为基础的学科。
资料表明:高铁酸钾(K2FeO4)固体也能用于制取氧气,原理如下:
方法一:4K2FeO4
 2Fe2O3+4K2O+3O2↑
2Fe2O3+4K2O+3O2↑方法二:4K2FeO4+10H2O==4Fe(OH)3↓+8KOH+3O2↑
某同学想用如图所示装置制取氧气,回答下列问题:
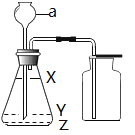
(1)仪器a名称是___________________;
(2)该同学选择方法_______(填“一”或“二”)作为实验方案。实验时液面应位于______(填“X”或“y”或“Z”)处。气体验满的方法是___________________________________;
(3)写出用该套装置制取另一种气体的方程式______________________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学利用如图装置探究铁与氧化铁化合的生成物成分。

【认识仪器】由仪器N可知该反应的条件是_____________。
【查阅资料】铁的氧化物中只有Fe3O4能被磁铁吸引。
某些铁的氧化物加热时能与氧气反应。
【提出猜想】猜想①是FeO;
猜想②是Fe3O4;
猜想③是FeO和Fe3O4混合物。
【实验步骤】
①连接组装仪器,检查装置的气密性,方法是:关闭弹簧夹M,_________________________________________________________。
②称取16.0g氧化铁粉末与质量为m的铁粉,均匀混合后,放入玻璃管。
③通入CO2,当观察到明显现象时,夹上弹簧夹M,开始加热玻璃管。
④当固体全部呈黑色后,停止加热,______________________________________。将玻璃管中黑色粉末倒在滤纸上,取样,滴加稀盐酸,无气泡产生,用磁铁吸引,粉末被部分吸引。
【实验结论】猜想_________成立。所加铁粉质量m的范围是_________________。
【问题讨论】实验中澄清石灰水的主要作用是______________________________。
相关试题

