【题目】甲、乙两同学对镁与盐酸反应进行系列研究。
甲、乙两同学取一根镁条,首先用砂纸打磨除去_______,观察到镁条的颜色_______。
研究Ⅰ:镁与盐酸反应过程中的能量变化以及反应速率的变化。
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),反应的化学方程式是________。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
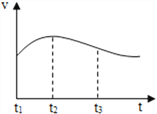
则t1-t2内反应速率逐渐加快的主要原因是________;
反思:t2-t3内反应速率逐渐减慢的主要原因是_________;
研究Ⅱ:反应后所得溶液的酸碱性探究。
(3)用pH试纸测定反应后所得溶液的酸碱度,发现pH略小于7。
甲同学:猜想Ⅰ:稀盐酸过量;猜想Ⅱ:氯化镁溶液呈弱酸性。
用pH试纸测定酸酸碱度的方法是_______。为验证猜想Ⅱ正确,可以通过查阅资料,也可以取纯净的________溶液并测定其酸碱度。
(4)乙同学将镁片(有剩余)投入适量稀盐酸,待不再产生气泡时立即测量pH,却发现所得溶液pH大于7,溶液冷却到室温后pH小于7。查阅资料发现①Mg+2H2O=Mg(OH)2↓+H2↑,②20℃时SMg(OH)2=0.009g,80℃时 SMg(OH)2=0.0108g。根据资料,乙同学实验中pH发生变化的原因是__________。
参考答案:
【答案】 表面的氧化膜(或氧化膜) 银白色 放热 Mg+2HCl=MgCl2+H2↑ 温度升高,反应速度加快 浓度降低,反应速度减慢 将待测液滴在pH试纸上,并与标准比色卡对比,读出读数 MgCl2 温度较高时Mg(OH)2溶解度大,溶液因Mg(OH)2而显碱性,室温时Mg(OH)2溶解度太小,溶液因MgCl2而显酸性
【解析】镁是活泼金属,故易于空气中的氧气反应,表面生成了氧化膜,故在实验中要先用砂纸打磨去掉氧化膜;纯镁是银白色的金属,故打磨后镁条变为银白色;
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是放热反应,反应方程式为Mg+2HCl=MgCl2+H2↑;
(2)该反应是放热反应,故t1-t2内反应速率逐渐加快;随着反应的进行,盐酸的浓度降低,故t2-t3内反应速率逐渐减慢;
(3)用pH试纸测定酸酸碱度的方法是将待测液滴在pH试纸上,并与标准比色卡对比,读出读数;为了验证猜想2,可以取纯净的氯化镁溶液测定其pH;
(4)溶液显碱性的原因是温度较高时Mg(OH)2溶解度大,溶液因Mg(OH)2而显碱性,室温时Mg(OH)2溶解度太小,溶液因MgCl2而显酸性
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,人类离不开化学。
(1)厨房化学知识
①下列食物中,能提供大量蛋白质的是________(填字母)。

②氯化钠在生活中最常用作防腐剂、调味品,国家强制在其中加入碘酸钾(KIO3),请标出碘酸钾中碘元素的化合价______,成年人缺乏碘元素会患有______。
③厨房中能用来除水垢的物质是______。
(2)生活原理知识
2017年《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”。口罩使用过程中,涂层中的氯化钠会溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,一段时间后,氯化钠再次析出。
④钠原子转化为钠离子,其核外电子数______(填“变大”或“变小”),常温下,氯化钠的饱和溶液中,氯化钠与水的质量比为______(已知:常温下,氯化钠的溶解度为36g)。
⑤构成氯化钠的阳离子符号为______,口罩使用过程中,氯化钠溶液中溶质质量分数一直保持不变,此判断_____ 。(填“正确”或“错误”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C为初中化学常见的物质,它们之间存在如图所示的转化关系(在一定条件下均能一步实现)。
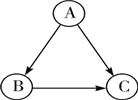
(1)若A、B组成元素相同,B是一种最常用的溶剂,C为气体单质,则A的化学式为______,A→C时常加入二氧化锰,其作用是_______。
(2)若B、C组成元素相同,A为黑色固体单质,C为可燃性气体化合物,则B→C的化学方程式为______,反应的基本反应类型为________。
(3)若A、B、C分别为NaCl、NaNO3、Na2SO4三种溶液中的一种。则C是______溶液;A→B的化学方程式为_______,此转化中产生的沉淀______(填“能”或“不能”)溶于稀硝酸。
-
科目: 来源: 题型:
查看答案和解析>>【题目】城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图:
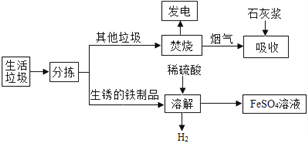
资料1:垃圾楚烧产生的烟气中含有SO2、HCl等气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
(1)发电厂是利用垃圾焚烧产生的________能转变为电能。
(2)在溶解步骤中,除产生H2的反应外,还发生了两个反应:_______(写出化学方程式)、Fe+Fe2(SO4)3=3FeSO4。
(3)将所得得硫酸亚铁溶液在氮气环境中蒸发浓缩、_________(填操作名称)、过滤,得到FeSO4·7H2O,其中氮气的作用是________。
(4)吸收步骤中,石灰浆的作用是_________。若1000g废气中含有1.6g二氧化硫,吸收这些二氧化硫至少需要_______________克Ca(OH)2?
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图相关信息回答下列问题。
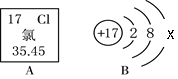
(1)氯元素属于______(填“金属”或“非金属”)元素。
(2)在氯原子结构示意图中,x =__________。
(3)氯离子在化学反应中__________电子变成氯原子。
(4)氯元素在周期表中应该排在第__________周期。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列实验装置,回答问题
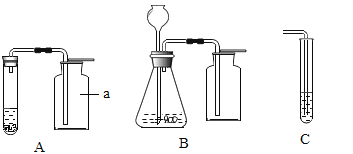
(1)标号为a的仪器名称是 ;
(2)装置A、B中,便于添加液体药品的是 ;
(3)在H2和O2中,可用装置B制取的是 ;
(4)若用装置C检验CO2,则试管中盛装的药品是 溶液;
(5)若制取8.8g CO2,理论上需要 g 10%的稀盐酸与足量大理石反应。
-
科目: 来源: 题型:
查看答案和解析>>【题目】去除粗盐中难溶性杂质,利用所得精盐配制溶液,回答问题:
(1)先称量5g粗盐,量取10mL水。然后将水倒入烧杯中,逐渐加入粗盐并用______________________搅拌,至粗盐不再溶解,称量剩余粗盐质量为1g;将浑浊液过滤,蒸发,得到3.4g精盐。
(2)根据(1)的数据,下列计算产率的计算式中正确的是__________;
A.
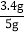 B.
B.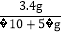 C.
C.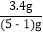 D.
D.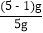
(3)在配制一定质量分数的氯化钠溶液过程中出现下列情况,不会对质量分数造成影响的是__________;
A.量取水时仰视读数
B.称量NaCl时右侧托盘没有放纸
C.氯化钠和水倒入烧杯后没有立刻搅拌
D.向细口瓶转移液体后烧杯中残留溶液
相关试题

