【题目】城市生活垃圾的处理是世界性难题,某垃圾处理厂对生活垃圾进行处理与综合利用的部分流程如图:
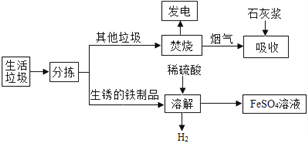
资料1:垃圾楚烧产生的烟气中含有SO2、HCl等气体。
资料2:+2价的铁元素容易被空气中的氧气氧化。
(1)发电厂是利用垃圾焚烧产生的________能转变为电能。
(2)在溶解步骤中,除产生H2的反应外,还发生了两个反应:_______(写出化学方程式)、Fe+Fe2(SO4)3=3FeSO4。
(3)将所得得硫酸亚铁溶液在氮气环境中蒸发浓缩、_________(填操作名称)、过滤,得到FeSO4·7H2O,其中氮气的作用是________。
(4)吸收步骤中,石灰浆的作用是_________。若1000g废气中含有1.6g二氧化硫,吸收这些二氧化硫至少需要_______________克Ca(OH)2?
参考答案:
【答案】 热 Fe2O3+3H2SO4==Fe2(SO4)3+3H2O 降温结晶 保护气 防止+2价的铁元素被空气中的氧气氧化 除去烟气中含有的SO2、HCl等有害气体
【解析】(1)垃圾焚烧可以放出热量,进行发电,该过程中将热能转化为电能;
(2)溶解过程中铁锈与稀硫酸也发生了反应,生成硫酸铁和水,反应方程式为Fe2O3+3H2SO4==Fe2(SO4)3+3H2O;
(3)硫酸亚铁的溶解度随温度的升高而升高,故用降温结晶的方法提纯硫酸亚铁;2价铁离子易被氧化为3价铁,故该过程需要在氮气的环境下进行;
(4)吸收步骤中,石灰浆的作用是除去烟气中含有的SO2、HCl等有害气体;
设吸收1.6g的二氧化硫至少需要氢氧化钙的质量为x
SO2+Ca(OH)2=CaSO3![]() +H2O
+H2O
64 74
1.6g x
![]() =
=![]() ,解得x=1.85g
,解得x=1.85g
-
科目: 来源: 题型:
查看答案和解析>>【题目】请结合下图回答问题。
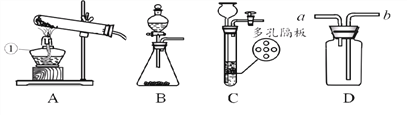
(1)写出有标号的仪器名称:①_______
(2)用氯酸钾和二氧化锰粉末制取氧气选用的发生装置是_______(选填序号),反应的化学方程式为________;实验室制取氧气能否选择用C装置达到控制反应的发生与停止的目的?_______(填“能”或“否”)
(3)实验室可用B或C装置制H2,反应的化学方程式为________,如果选择用D装置收集气体,气体应从_______通入。
(4)实验室使用的稀硫酸通常都是将浓硫酸用水稀释而成的。现欲用98%的硫酸(密度为1.84g/mL)配制19.6%的稀硫酸100 g,需要浓硫酸的体积为______mL(保留到小数点后一位),量取水时应选用规格(从10mL、50mL、100mL中选取)为______mL的量筒。
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学就在我们身边,人类离不开化学。
(1)厨房化学知识
①下列食物中,能提供大量蛋白质的是________(填字母)。

②氯化钠在生活中最常用作防腐剂、调味品,国家强制在其中加入碘酸钾(KIO3),请标出碘酸钾中碘元素的化合价______,成年人缺乏碘元素会患有______。
③厨房中能用来除水垢的物质是______。
(2)生活原理知识
2017年《科学报告》一篇文章称,只需在普通口罩上添加氯化钠涂层,就能将其转化为“特效口罩”。口罩使用过程中,涂层中的氯化钠会溶解于病毒自身携带的水中,形成溶液,杀死病毒;杀死病毒后,水分蒸发,一段时间后,氯化钠再次析出。
④钠原子转化为钠离子,其核外电子数______(填“变大”或“变小”),常温下,氯化钠的饱和溶液中,氯化钠与水的质量比为______(已知:常温下,氯化钠的溶解度为36g)。
⑤构成氯化钠的阳离子符号为______,口罩使用过程中,氯化钠溶液中溶质质量分数一直保持不变,此判断_____ 。(填“正确”或“错误”)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】A、B、C为初中化学常见的物质,它们之间存在如图所示的转化关系(在一定条件下均能一步实现)。
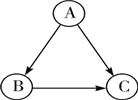
(1)若A、B组成元素相同,B是一种最常用的溶剂,C为气体单质,则A的化学式为______,A→C时常加入二氧化锰,其作用是_______。
(2)若B、C组成元素相同,A为黑色固体单质,C为可燃性气体化合物,则B→C的化学方程式为______,反应的基本反应类型为________。
(3)若A、B、C分别为NaCl、NaNO3、Na2SO4三种溶液中的一种。则C是______溶液;A→B的化学方程式为_______,此转化中产生的沉淀______(填“能”或“不能”)溶于稀硝酸。
-
科目: 来源: 题型:
查看答案和解析>>【题目】甲、乙两同学对镁与盐酸反应进行系列研究。
甲、乙两同学取一根镁条,首先用砂纸打磨除去_______,观察到镁条的颜色_______。
研究Ⅰ:镁与盐酸反应过程中的能量变化以及反应速率的变化。
(1)反应中试管外壁发烫,说明镁与稀盐酸反应是_______反应(填“吸热”或“放热”),反应的化学方程式是________。
(2)实验测得镁片产生气体的速率(v)与时间(t)的关系如图所示,
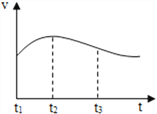
则t1-t2内反应速率逐渐加快的主要原因是________;
反思:t2-t3内反应速率逐渐减慢的主要原因是_________;
研究Ⅱ:反应后所得溶液的酸碱性探究。
(3)用pH试纸测定反应后所得溶液的酸碱度,发现pH略小于7。
甲同学:猜想Ⅰ:稀盐酸过量;猜想Ⅱ:氯化镁溶液呈弱酸性。
用pH试纸测定酸酸碱度的方法是_______。为验证猜想Ⅱ正确,可以通过查阅资料,也可以取纯净的________溶液并测定其酸碱度。
(4)乙同学将镁片(有剩余)投入适量稀盐酸,待不再产生气泡时立即测量pH,却发现所得溶液pH大于7,溶液冷却到室温后pH小于7。查阅资料发现①Mg+2H2O=Mg(OH)2↓+H2↑,②20℃时SMg(OH)2=0.009g,80℃时 SMg(OH)2=0.0108g。根据资料,乙同学实验中pH发生变化的原因是__________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下图相关信息回答下列问题。
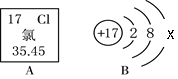
(1)氯元素属于______(填“金属”或“非金属”)元素。
(2)在氯原子结构示意图中,x =__________。
(3)氯离子在化学反应中__________电子变成氯原子。
(4)氯元素在周期表中应该排在第__________周期。
-
科目: 来源: 题型:
查看答案和解析>>【题目】结合下列实验装置,回答问题
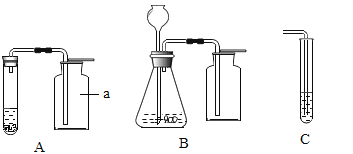
(1)标号为a的仪器名称是 ;
(2)装置A、B中,便于添加液体药品的是 ;
(3)在H2和O2中,可用装置B制取的是 ;
(4)若用装置C检验CO2,则试管中盛装的药品是 溶液;
(5)若制取8.8g CO2,理论上需要 g 10%的稀盐酸与足量大理石反应。
相关试题

