【题目】在实验室制取氧气时,取MnO2和KClO3的固体混合物15.25g,加热至不再产生气体为止,收集到一定质量的氧气。某化学兴趣小组欲求得所制氧气的质量,他们将加热后剩余物冷却到一定温度后,通过多次加水测定剩余物质量的办法即可求出。加水的质量与剩余固体的质量见下表:(MnO2是不溶于水的固体粉末)
编号 | 1 | 2 | 3 | 4 |
加水的质量(g) | 10 | 10 | 10 | 10 |
剩余固体的质量(g) | 7.25 | 4.05 | m | 3 |
试求:
(1)表中m值为_____;
(2)混合物中KClO3的质量_____;
(3)所制得氧气的质量____恰好完全反应后固体中氯化钾的质量分数____(写出具体计算过程,质量分数保留0.01%)。
参考答案:
【答案】3 12.25 4.8g 71.29%
【解析】
根据第二次加水导致固体减少7.25g﹣4.05g=3.2g,所以第一次未加水前为7.25g+3.2g=10.45g,则根据质量守恒定律可得,生成的氧气的质量为15.25g﹣10.45g=4.8g。而第四次加水后固体为3g,可知,第三次也应该为3g,剩余3g为二氧化锰,则氯化钾的质量为10.45g﹣3g=7.45g。氯酸钾的质量为15.25g﹣3g=12.25g。恰好完全反应后固体中氯化钾的质量分数为![]() ×100%≈71.29%
×100%≈71.29%
-
科目: 来源: 题型:
查看答案和解析>>【题目】请根据下列装置如图1,回答问题:
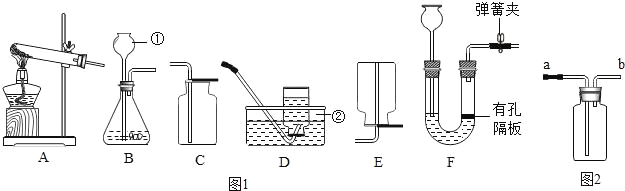
(1)写出标号①②的仪器名称:①_____,②_____.
(2)某同学想要用高锰酸钾制制取一瓶较干燥的氧气,他应该选择_____组合.装置A还需做的一点改动是_____,写出高锰酸钾制取氧气的化学方程式_____.
(3)如果选择BD组合可以制取_____气体,写出该反应的化学方程式_____.
(4)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应),通过溶解、过滤、_____干燥就能得到纯净的二氧化锰固体.
(5)把(4)中滤液蒸发结晶可得到氯化钾晶体,在蒸发操作中玻璃棒的作用是_____.
(6)若选择装置F作为制取氢气的发生装置,其优点是_____.如果如图2所示的装置来收集一瓶氧气,验满时应该将带火星的木条放在_____.(选填“a”或“b”)导管口处.
-
科目: 来源: 题型:
查看答案和解析>>【题目】(9分)水蒸气通过灼热的焦炭后得到的混合气体有哪些成分?某化学兴趣小组在老师的指导下,对此进行了实验探究。
【提出猜想】1.该混合气体只含有一氧化碳、氢气
2.该混合气体含有一氧化碳、二氧化碳、氢气和水蒸气
3.该混合气体只含有二氧化碳、氢气和水蒸气
4.该混合气体只含有一氧化碳、二氧化碳和氢气
【查阅资料】a.无水硫酸铜遇水由白色变为蓝色。
b.碱石灰是固体氢氧化钠和氧化钙的混合物。
c.浓硫酸具有强烈的吸水性,常用作某些气体的干燥剂
【实验过程】同学们在老师的指导下设计了如下图所示装置,并进行了实验(部分夹持仪器已略去)。
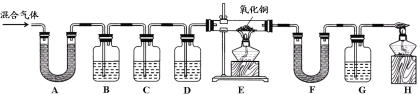
(1)装置A中无水硫酸铜变蓝,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有 。B中变化的化学方程式为 。
(2)装置C中的药品为 。
(3)E中氧化铜变红、F中无水硫酸铜变蓝、G中澄清石灰水变浑浊,说明混合气体中还存在的气体是 ; E中的变化说明氧化铜具有 性。
【实验结论】猜想 正确。
【实验反思】
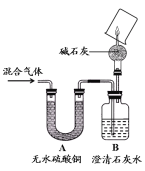
经过讨论,同学们将上图中装置C~H进行了简化,只 用下图所示装置并自选必要试剂就能完成探究。其中,干燥管中碱石灰的作用为 , 烧杯上能观察到的现象是 。最后一步的实验操作及现象是 。
-
科目: 来源: 题型:
查看答案和解析>>【题目】已知A﹣E都是初中化学中的常见物质,其中A和D是无色无味气体,B是黑色粉末,C是红色固体,它们的转化关系如图所示(部分反应的反应条件或生成物已省略).
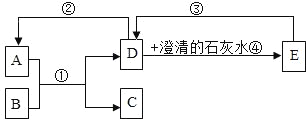
(1)写出C物质的化学式:_____.
(2)写出反应①的化学方程式:_____;若反应③的反应条件是高温,请写出反应③的化学方程式:_____,属于_____反应(填基本反应类型).
(3)D能转化为A,还需要的物质是_____.
-
科目: 来源: 题型:
查看答案和解析>>【题目】化学用语是国际通用语言,下列有关化学用语所表达的意义不正确的是
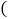
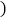
A. H--氢元素 B.
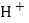 --氢离子
--氢离子C.
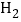 --2个氢原子 D.
--2个氢原子 D. 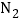 --氮分子
--氮分子 -
科目: 来源: 题型:
查看答案和解析>>【题目】世界杯足球赛中,当运动员肌肉受伤时,队医随即对准球员的受伤部位喷射药剂氯乙烷
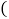 化学式为
化学式为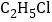 ,沸点为
,沸点为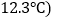 进行局部冷冻麻醉处理。下列有关氯乙烷的说法不正确的
进行局部冷冻麻醉处理。下列有关氯乙烷的说法不正确的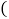
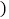
A. 从宏观上看:氯乙烷是碳、氢、氯三种元素组成
B. 从微观上看:一个氯乙烷分子是由8个原子构成
C. 从质量上看氯乙烷中碳、氢、氯三种元素的质量比为2:5:1
D. 从类别上看:氯乙烷属于化合物
-
科目: 来源: 题型:
查看答案和解析>>【题目】氨催化氧化是制硝酸的主要反应之一,该反应的微观示意图如图所示。下列说法不正确的是
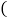
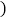
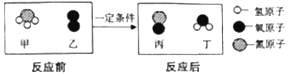
A. 该反应不属于化合反应
B. 生成物都是化合物
C. 参加反应的甲乙的质量比为17:32
D. 生成的丙与丁的分子个数比为2:3
相关试题

