5.侯德榜是我国著名的化学家。由他发明的侯氏制碱法制得的纯碱中可能含有少量氯化钠。现取仅含氯化钠杂质的纯碱样品33.2g,加入130g稀盐酸中,恰好完全反应,得氯化钠溶液150g。
求:(1)该纯碱样品中Na2CO3的质量;
(2)反应后所得溶液中溶质的质量分数。
4.(1)曲酸(C6H6O4)是一种新型添加剂,它具有广泛的抗菌作用,作为防腐剂添加于食品中,具有非常好的效果.曲酸的相对分子质量是 ,曲酸中碳、氢、氧三种元素的质量比是
(2)某工厂的废料中含铁和铜,需回收此废料中的铜.现取铁和铜的混合物样品l0g,向其中加入废弃的稀硫酸50g恰好完全反应,产生0.1gH2。
求:①废料中铜的质量分数。
②废弃稀硫酸中硫酸的质量分数。
3.(5分)由硫元素和铜元素组成的一种化合物(硫化物)4.0g,高温条件下在空气中充分煅烧,只得到气体SO2和4.0g固体CuO 。
(1)要使煅烧后的固体CuO完全溶解,可加入适量稀硫酸。计算至少需要溶质质量分数为10%的稀硫酸多少克?(要求写出计算所需的化学方程式)
(2)运用所学知识和上述数据进行分析,这种硫化物的化学式为 。
2.刘彬同学的姑父从三峡搬迁到我们家乡后,准备兴建一
座碳酸钙精粉厂。为检测当地石灰石中碳酸钙的纯度,
他在实验室用6g石灰石样品(杂质不参加反应)与19g
稀盐酸恰好完全反应,测得残留物为22.8g。 求:
(1)依椐质量守恒定律,生成二氧化碳 g;
(2)样品中碳酸钙的质量分数;
(3)所用稀盐酸溶液中溶质的质量分数。
1.用氯酸钾和二氧化锰的混合物16g,加热制取氧气,待完全反应,冷却后称量,得到11.2g
固体物质,计算原混合物中二氧化锰的质量(计算结果保留二位小数)。
36. 称取氯化钠和氯化钙的固体混合物14g,放入烧杯中。加入96克碳酸钠溶液恰好完全反应(反应的方程式为: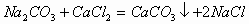 ),待反应完全后过滤称得滤液的总质量为100g。
),待反应完全后过滤称得滤液的总质量为100g。
(1)根据质量守恒定律,可知生成的沉淀质量为__________________
(2)固体混合物中氯化钙的质量是多少?
(3)所得滤液中溶质的质量分数是多少?
35. 某金属氧化物R2O能与水反应生成ROH,已知在R2O中的R元素与氧元素的质量比为23:8。现将质量为m的水加到6.2g该金属氧化物中,得到溶质质量分数为16%的溶液。试求:
(1)该金属元素R的相对原子质量。
(2)加到该金属氧化物中水的质量m。
34. 氯化钠样品中混有少量碳酸钠,某学生欲用下面两种方法进行提纯。
方法一:样品溶于蒸馏水,加稍过量的盐酸,蒸干溶液。
方法二:样品溶于蒸馏水,加稍过量的石灰水,过滤向滤液中加稍过量的盐酸,蒸干溶液。
你认为这两种方法中_____________不合适,理由是________________。
33. (8分)某学生为了测定由两种元素形成的化合物X的组成(该气体的水溶液呈酸性,且该气体有还原性),按图6所示装置进行实验。
把气体X由注射器A缓慢地送入装有CuO的B装置,使之完全反应,得到如下结果:

图6
(1)实验前,B管及CuO的质量为21.32g;实验后,B管及残留固体物质的质量为21.16g。
(2)C试管中收集到的物质经过电解可得到H2和O2,在D注射器中收集到的是N2。
(3)经分析知道,X中两元素的质量比为14:3。
回答下列问题:
(1)C管中收集到的液体的化学式是___________,该物质电解的化学方程式为:_________________________。
(2)B管中的现象为:_______________________。
(3)B管反应前后减轻的质量为_________________g,这部分的质量是CuO失去的_______________元素的质量,可推知跟该元素结合的另一元素(写元素符号)______________的质量为_______________g。
(4)化合物X的化学式为__________________。
(5)X与CuO共热时反应的化学方程式为______________________。
32. (3分)某氢气样品中,混有少量水蒸气及氯化氢气体。若要求:(1)证明混有这两种气体;(2)除去这两种气体并确认氯化氢已除尽。请根据图5提供的装置(每种装置均有若干个)设计一个连续实验,并回答问题:
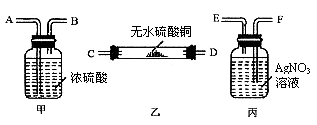
图5
(1)用接口字母表示装置连接的顺序:不纯的氢气→_________→纯净的氢气。
(2)甲装置的作用:________________
(3)丙装置的作用:________________

