1图1信息能说明
A分子很小
B分子间有间隔
C分子总是在不断运动
D分子是构成物质的唯一微粒
2碳铵(NH4HCO3 )能使作物枝繁叶茂,果实硕大。碳铵属于
A钾肥 B磷肥 C氮肥 D复台肥
3.图2所示实验操作正确的是

31. (8分) 某同学向盛有少量碳酸钠溶液的烧杯中滴入氯化钙溶液,立即产生白色沉淀,过滤后得到澄清滤液,你认为滤液中含有哪些溶质?请你猜想,并设计实验来验证。
[猜想]:
猜想①:滤液中的溶质有 碳酸钠、 氯化钠 ;
猜想②:滤液中的溶质有 ;
猜想③:滤液中只有 。
[设计实验]:
请你设计实验方案来验证以上猜想,并将有关内容填写在以下实验报告的空格内。
|
实验步骤 |
实验现象及有关化学方程式 |
结论 |
|
|
|
猜想①正确 |
|
|
|
猜想②正确 |
|
|
|
猜想③正确 |
30. (6分)铁是工农业生产和人们生活离不开的重要金属材料之一。
(1)工业上利用高炉炼铁所需原料有铁矿石、焦炭、石灰石,其中,焦炭的作用是
;用一氧化碳和赤铁矿(主要成分氧化铁)反应炼铁的化学方程式 。
(2)通过以上方法得到的是生铁,另一种铁合金的名称是 。
(3)为探究铁钉锈蚀条件,一位同学设计了以下实验:
|
|
实验一 |
实验二 |
|
实验装置 |
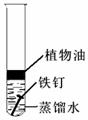 |
 |
|
10天后观察到的实验现象 |
铁钉表面没有明显的锈斑 |
铁钉表面有明显的锈斑 |
该同学根据以上实验现象得出了铁钉锈蚀是铁与空气中的氧气、水蒸气等发生化
学反应的过程。你认为,该同学的以上实验方案是否合理 (填“合理”或“不合理”),理由是
。
(4)请举出一个防止铁制品生锈的实例
。
29. (4分)如右图所示,在A烧杯中加入少量氢氧化钠溶液,并滴入几滴酚酞溶液;在B烧杯中加入足量的浓盐酸,然后用一个大烧杯罩住A、B两个小烧杯。
(4分)如右图所示,在A烧杯中加入少量氢氧化钠溶液,并滴入几滴酚酞溶液;在B烧杯中加入足量的浓盐酸,然后用一个大烧杯罩住A、B两个小烧杯。
请回答:
(1)放置一段时间后,A烧杯中的现象是
,溶液的pH (填“升高”、
“降低”或“不变”)。
(2)该现象说明浓盐酸具有的性质是(列举两条):
① ;
② 。
28.(7分)以下是配制100g质量分数为5%的氯化钠溶液的操作示意图。

A B C D E
请回答:
(1)仪器①、②的名称是:① ,② 。
(2)在上图所示的配制全过程中,正确的操作顺序是 (填字母);需水 mL。
(3)在C操作中,量水时,量筒必须放平,视线要与量筒内液体凹面的 处保持水平。
(4)A操作的名称是 ;B操作的作用是 。
27.( 6分)已知A、E是碱,X、Y是酸,其余的物质都是盐,G是不溶于稀硝酸的白色沉淀,它们之间的转化关系如下图所示。

请回答:
(1)写出有关物质的化学式:A ;F 。
(2)写出下列反应的化学方程式:
A+B: ;
D+F: 。
26.(4分)某同学用一个质地较软的矿泉水瓶收集一瓶CO2气体,迅速往其中注入A物质的浓溶液,立即用橡皮塞塞紧瓶口,摇动矿泉水瓶,矿泉水瓶很快变瘪,则A是 ;再用注射器向瓶内注入B溶液,变瘪的矿泉水瓶立即又鼓起来,则B是 。请写出以上两个变化的化学方程式:
(1) ;
(2) 。
25.(10分)钾是农作物生长所必需的一种营养元素。现有一种钾肥样品,其成分为碳酸钾和硫酸钾。某同学为测定该钾肥中碳酸钾的质量分数,在10g钾肥样品中逐滴加入溶质质量分数为20%的硫酸溶液至恰好完全反应,测得消耗硫酸溶液的质量为24.5g,该过程中发生反应的化学方程式为 。
请计算:
(1)24.5g20%的硫酸溶液中,溶质的质量为 g。
(2)钾肥样品中碳酸钾的质量分数为 。
(3)硫酸钾中钾元素的质量分数为 (精确到0.1%); g硫酸钾中含有39g钾元素。
24.(3分)硝酸钾和氯化钠在不同温度下的溶解度如下表所示:
|
温度(℃) |
0 |
20 |
40 |
60 |
80 |
100 |
|
硝酸钾的溶解度(g) |
13.3 |
31.6 |
63.9 |
110 |
169 |
246 |
|
氯化钠的溶解度(g) |
35.7 |
36.0 |
36.6 |
37.3 |
38.4 |
39.8 |
请根据上表中的数据回答问题:
(1)40℃时,硝酸钾饱和溶液的质量分数 氯化钠饱和溶液的质量分数(填“等于”“大于”或“小于”)。
(2)硝酸钾和氯化钠溶解度可能相同的温度范围是 ℃。
(3)要从含有少量氯化钠的硝酸钾溶液中分离出硝酸钾,应采用的方法是
。

