【题目】下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3H2O占初始时NH3H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3H2O)
参考答案:
【答案】A
【解析】
A. 根据溶液中的pH,计算出溶液中的c(OH),结合电离度的定义分析;
B. 等浓度等体积的氨水与盐酸混合后,溶液中溶质为氯化铵;
C. 氯化铵促进水的电离,盐酸抑制水的电离;
D. 根据物料守恒规律得出结论。
A. 常温下a点时溶液的pH=11,则已电离的氢氧根离子浓度c(OH) = ![]() =
= ![]() = 10-3mol/L, NH3·H2O起始的物质的量浓度为0.1mol/L,则电离度 =
= 10-3mol/L, NH3·H2O起始的物质的量浓度为0.1mol/L,则电离度 = ![]() ×100% = 1%,故A项正确;
×100% = 1%,故A项正确;
B. b点时,氨水与盐酸恰好完全反应生成氯化铵,因铵根离子的水解使溶液显酸性,则pH<7,故B项错误;
C. b点时溶液的溶质为氯化铵,c点时,溶液的溶质为氯化铵与氯化氢,因过量的酸会抑制水的电离可知,水的电离程度:b>c,故C项错误;
D. c点时溶液中溶质为等物质的量浓度的NH4Cl与HCl,其溶液中存在物料守恒,即c(Cl) = 2[c(NH4+) + c(NH3·H2O)],故D项错误;
答案选A。
-
科目: 来源: 题型:
查看答案和解析>>【题目】铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为
 ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是
A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e = xC + PF6
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
-
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应N2(g)+3H2(g)
 2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )
2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )A. 0.1 mol·L-1 B. 0.2 mol·L-1 C. 0.05 mol·L-1 D. 0.15 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的俗名与化学式对应正确的是
A.熟石灰——CaOB.水晶——H2O
C.干冰——CO2D.漂白粉——NaClO
-
科目: 来源: 题型:
查看答案和解析>>【题目】世界能源消费的90%以上依靠化学技术。回答下列问题:
(1)质子交换膜燃料电池中作为燃料的H2通常来自水煤气。
已知:C(s)+
 O2(g)=CO(g) △H1=-110.35kJ·mol-1
O2(g)=CO(g) △H1=-110.35kJ·mol-12H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
H2O(1)=H2O(g) △H3=+44.0kJ·mol-1
则反应C(s)+H2O(g)
 CO(g)+H2(g) △H4=___________。
CO(g)+H2(g) △H4=___________。某实验小组在实验室模拟反应C(s)+H2O(g)
 CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。
CO(g)+H2(g),其平衡常数表达式为K=___________。一定温度下,在2L盛有足量炭粉的恒容密闭容器中通入0.8molH2O,6min时生成0.7gH2。则6min内以CO表示的平均反应速率为___________(保留3位有效数字)。(2)燃料气(主要含N2和H2,还含有少量其他杂质)中的CO会使电极催化剂中毒,使用CuO/CeO2催化剂可使CO优先氧化而脱除。CeO2可由草酸铈[Ce(C2O4)3]灼烧制得,反应的化学方程式为___________。在CuO/CeO2催化剂中加入不同的酸(HIO3或H3PO4),测得燃料气中CO优先氧化的转化率随温度的变化如下图所示。
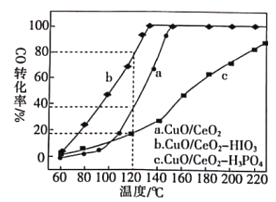
加入H3PO4___________(填“促进”或“抑制”)CuO/CeO2的催化。温度为120℃,催化剂为CuO/CeO2-HIO3时,若燃料气流速为1800mL·min-1,CO的体积分数为0.68%,则反应0.5h后CO的体积为___mL。
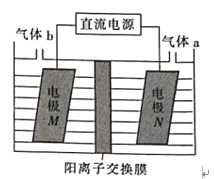
(3)LiOH是制备锂离子电池正极材料的重要原料,利用LiCl溶液电解制备得LiOH的装置如下图,LiOH在___________(填“M极”或“N极”)制得,N极产生的气体a通入淀粉KI溶液溶液变蓝,持续一段时间后,蓝色可逐渐褪去。据此写出N极的电极反应式:__________,蓝色逐渐褪去是因为溶液中逐渐生成HIO3,写出此反应的化学方程式:______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】关于0.1mol·L-1NaHCO3溶液,下列说法正确的是
A. 溶质水解反应:HCO3- +H2O
 H3O++CO32-
H3O++CO32-B. 离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-)
C. 微粒浓度关系:c(Na+)>c(HCO3-) >c(H2CO3)>c(CO32-)
D. 微粒浓度关系:c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列变化需要加入还原剂才能实现的是( )
A.HCl
 Cl2B.Fe
Cl2B.Fe Fe3+C.KClO3
Fe3+C.KClO3 O2D.KMnO4→Mn2+
O2D.KMnO4→Mn2+
相关试题

