【题目】铝石墨双离子电池是一种全新的低成本、高效能电池,反应原理为![]() ,电池结构如图所示。下列说法正确的是
,电池结构如图所示。下列说法正确的是

A. 放电时,外电路中电子向铝锂电极移动
B. 充电时,应将铝石墨电极与电源负极相连
C. 放电时,正极反应式为Cx(PF6) +e = xC + PF6
D. 充电时,若电路中转移1mol电子,则阴极质量增加9g
参考答案:
【答案】C
【解析】
A. 放电时,外电路中电子向正极移动;
B. 充电时,铝石墨电极的C元素化合价升高,发生氧化反应,为电解池的阳极;
C. 依据原电池的工作原理书写电极反应式;
D. 阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi;
A. 放电过程为原电池原理,外电路电子从负极流出,流向正极。根据反应总方程式可知,该装置放电过程中,锂元素化合价升高发生氧化反应,碳元素化合价降低发生还原反应,所以铝锂电极做负极,铝石墨电极做正极,则外电路电子向铝石墨电极移动,故A项错误;
B. 充电过程为放电过程的逆过程,铝石墨电极作为阳极与电源的正极相连,故B项错误;
C. 放电时正极发生还原反应,其电极反应式可表示为:Cx(PF6) +e = xC + PF6,故C项正确;
D. 充电时,阴极锂离子发生还原反应,电极反应为:Al+Li++e-═AlLi,所以转移1 mol e-,阴极电极从Al变为AlLi将增重1 mol×7g/mol = 7 g,故D项错误;
答案选C。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某同学利用50mL0.50mol/L的盐酸与50mL0.55mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量计算中和热。请回答下列问题:

(1)写出仪器A的名称______________;
(2)碎泡沫塑料的作用是__________________________;
(3)实验测得放出的热量为1.4kJ,写出其表示中和热的化学方程式____________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】在一定温度下,10L密闭容器中加入5molSO2、4molO2,经10min后反应达平衡时有3molSO2发生了反应.试计算:
(1)用SO2表示该反应的反应速率为______。
(2)平衡时O2的转化率为______。
(3)平衡时O2在反应混合气中的物质的量分数______。
(4)平衡常数K值为______。
-
科目: 来源: 题型:
查看答案和解析>>【题目】可以证明可逆反应N2+3H2
 2NH3已达到平衡状态的是
2NH3已达到平衡状态的是①一个N≡N键断裂的同时,有3个H﹣H键断裂
②一个N≡N键断裂的同时,有6个N﹣H键断裂
③其他条件不变时,混合气体平均相对分子质量不再改变
④恒温恒容时,体系压强不再改变
⑤NH3、N2、H2的体积分数都不再改变
⑥恒温恒容时,混合气体密度保持不变
⑦正反应速率v(H2)=0.6molL﹣1min﹣1,逆反应速率v(NH3)=0.4molL﹣1min﹣1
A. 全部 B. ②③④⑤ C. ②③④⑤⑦ D. ③⑤⑥⑦
-
科目: 来源: 题型:
查看答案和解析>>【题目】可逆反应N2(g)+3H2(g)
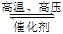 2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )
2NH3(g),在容积为10 L的密闭容器中进行,开始时加入2 mol N2和3 mol H2,则达到平衡时,NH3的浓度不可能为( )A. 0.1 mol·L-1 B. 0.2 mol·L-1 C. 0.05 mol·L-1 D. 0.15 mol·L-1
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列物质的俗名与化学式对应正确的是
A.熟石灰——CaOB.水晶——H2O
C.干冰——CO2D.漂白粉——NaClO
-
科目: 来源: 题型:
查看答案和解析>>【题目】下图为常温下向10mL0.1 mol·L-1 NH3·H2O中加入等浓度的盐酸时,NH3·H2O的物质的量随V(盐酸)的变化曲线。(电离度为已电离的NH3H2O占初始时NH3H2O的百分比),下列说法正确的是( )

A. 测得a点时溶液的pH=11,则NH3·H2O的电离度为1%
B. b点时溶液的pH=7
C. 水的电离程度:b<c
D. c点时溶液中存在关系式:2c(Cl-)=c(NH4+) +c(NH3H2O)
相关试题

