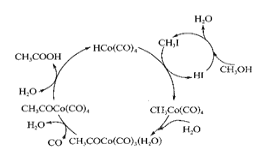
【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有![]() 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
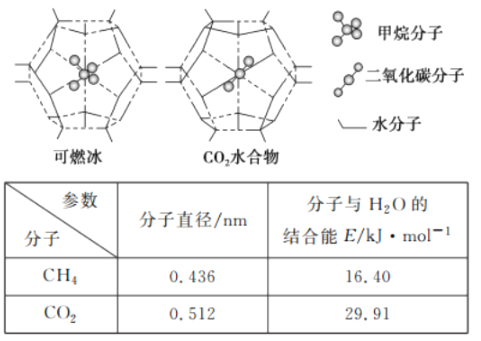
(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
参考答案:
【答案】LiCoO2 CH3OH+CO![]() CH3COOH
CH3COOH ![]() 14 SO3 CO2的分子直径小于笼状空腔直径,且CO2与H2O的结合能大于CH4与H2O的结合能
14 SO3 CO2的分子直径小于笼状空腔直径,且CO2与H2O的结合能大于CH4与H2O的结合能
【解析】
(1)由锂钴复合氧化物晶体的结构可知,Li离子在晶胞中6个位于中棱、4个位于上下棱、1个位于体内、2个位于测面心,Li离子个数为:6×1/3+4×1/4+1+2×1/2=5个, Co离子在晶胞中12个位于顶点、4个位于上下面心、4个位于上下棱,Co离子个数为:12×1/6+4×1/2+4×1/4=5个,O离子在晶胞中18个位于中棱、2个位于体内、4个位于测面心,Li离子个数为:18×1/3+2+4×1/2=10个, Li离子、Co离子和O离子个数比为5:5:10=1:1:2,化学式为LiCoO2,故答案为:LiCoO2;
(2)由图可知右边下面进去1mol的水,而上面又出来1mol的水,所以实际反应的是甲醇;左边上面进去1mol的水,而下面又出来1mol的水,参与反应的是一氧化碳,而生成的醋酸,所以总反应的方程式为:CO+CH3OH![]() CH3COOH,故答案为:CO+CH3OH
CH3COOH,故答案为:CO+CH3OH![]() CH3COOH;
CH3COOH;
(3)Co是27号元素,核外电子数为27,其核外电子排布式为:1s22s22p63s23p63d74s2,价电子排布式为3d74s2,则其价电子排布图为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)CH3COCo(CO)4配位化合物中,中心原子Co与配体形成5个δ键,CH3CO中有5个δ键,4个CO中共有4个δ键,共有14个个δ键;CO32—的原子个数为3、价电子数为24,则与其具有相同原子个数和价电子数的等电子体分子为SO3,故答案为:SO3;
(5) 由表格可知:二氧化碳的分子直径小于笼状结构的空腔直径,即0.512<0.586,能顺利进入笼状空腔内,且二氧化碳与水的结合能力强于甲烷,即29.91>16.40,故答案为:CO2的分子直径小于笼状空腔直径,且与H2O的结合能大于CH4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】高分子化合物V:
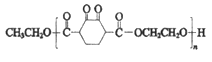 是人造棉的主要成分之一,合成路线如下:
是人造棉的主要成分之一,合成路线如下: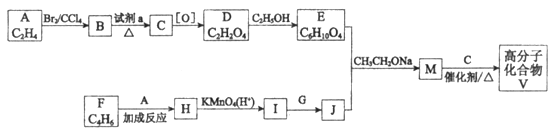
已知:
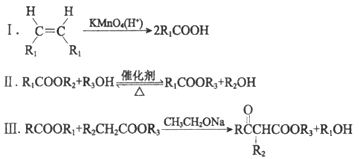
(R、R1、R2、R3表示烃基)
(1)试剂a是____________________________。
(2)F与A以物质的量之比1:1发生反应生成六元环状化合物H,H的结构简式是________________。
(3)I的结构简式是____________。
(4)G中所含官能团是________________;M的结构简式是____________。
(5)M与C反应生成V的化学方程式为____________。
(6)E的同分异构体N也可以和J反应生成M,N可能的结构简式为____________(写一种)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】某溶液中有Fe3+、Fe2+、Mg2+和Al3+四种离子,若向其中加入过量的Na2O2并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是( )
A.Mg2+B.Fe3+C.Fe2+D.Al3+
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫、钒、钴、铂、镧的相关化合物,在药物化学及催化化学等领城应用广泛。回答下列问题:
(1)基态钒原子的电子排布式为__________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______.VO43—的几何构型为_________。
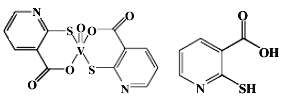
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是_______.所含第二周期元素第一电离能由大到小的排列顺序为_____________。
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是___________________。
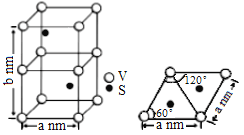
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为______。为该晶胞俯视图,该晶胞的密度为_____g·cm-3(NA为阿伏加德罗常数的数值.列出计算式即可)。
-
科目: 来源: 题型:
查看答案和解析>>【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
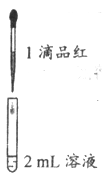
试管中的液体
现象
a. 0.1 mol/L SO2溶液(pH=2)
溶液逐渐变浅,约90s后完全褪色
b. 0.1 mol/L NaHS03溶液(pH=5)
溶液立即变浅,约15s后完全褪色
c. 0.1 mol/L Na2SO3溶液( pH=10)
溶液立即褪色
d. pH=10NaOH溶液
红色溶液不变色
e. pH=2H2SO4溶液
红色溶液不变色
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作
现象

i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】C、N和Si能形成多种高硬度材料,如SiN4、C3N4、SiC
(1)Si3N4和C3N4中硬度较高的是________,理由是_____________。
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有________。
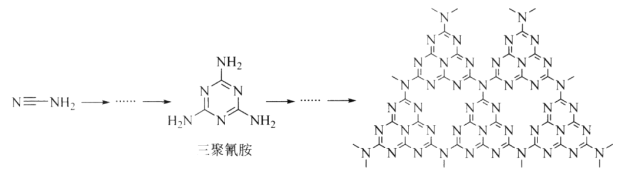
(3)C和N能形成一种五元环状有机物咪唑(简写为im),其结构为
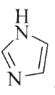 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下: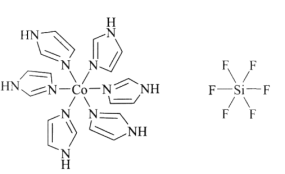
①阳离子[Co(im)6]2+和SiF62—之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:_______。(例如水中氢键的表示式为
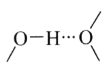 )
)②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键” π34,则im分子中存在的“离域π键”是______。
(4)
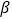 -SiC为立方晶系晶体,该晶胞中原子的坐标参数为
-SiC为立方晶系晶体,该晶胞中原子的坐标参数为C:(0,0,0);
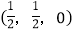 ;
;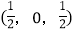 ;
;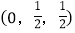 ;……
;……Si:
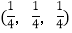 ;
;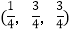 ;
;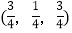 ;
;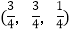
则
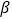 -SiC立方晶胞中含有_____个Si原子、________个C原子。
-SiC立方晶胞中含有_____个Si原子、________个C原子。 -
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于苯乙烷(
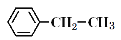 )的叙述,正确的是
)的叙述,正确的是①能使酸性高锰酸钾溶液褪色 ②可以发生加聚反应 ③可溶于水 ④可溶于苯 ⑤能与浓硝酸发生取代反应 ⑥所有原子可能共面
A. ①④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
相关试题

