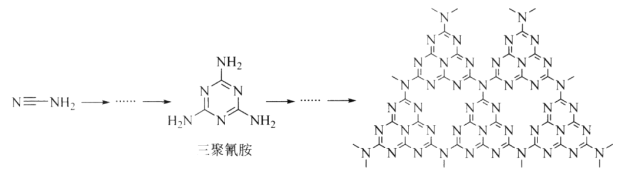
【题目】C、N和Si能形成多种高硬度材料,如SiN4、C3N4、SiC
(1)Si3N4和C3N4中硬度较高的是________,理由是_____________。
(2)C和N能形成一种类石墨结构材料,其合成过程如下图所示。该类石墨结构材料化合物的化学式为_______,其合成过程中有三聚氰胺形成,三聚氰胺中N原子的杂化方式有________。
(3)C和N能形成一种五元环状有机物咪唑(简写为im),其结构为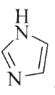 。化合物[Co(im)6]SiF6的结构示意图如下:
。化合物[Co(im)6]SiF6的结构示意图如下:
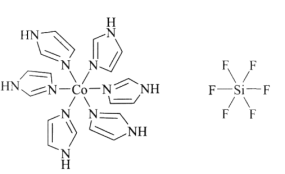
①阳离子[Co(im)6]2+和SiF62—之间除了阴阳离子间的静电作用力,还存在氢键作用写出该氢键的表示式:_______。(例如水中氢键的表示式为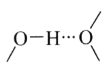 )
)
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键” π34,则im分子中存在的“离域π键”是______。
(4)![]() -SiC为立方晶系晶体,该晶胞中原子的坐标参数为
-SiC为立方晶系晶体,该晶胞中原子的坐标参数为
C:(0,0,0);![]() ;
;![]() ;
;![]() ;……
;……
Si:![]() ;
;![]() ;
;![]() ;
;![]()
则![]() -SiC立方晶胞中含有_____个Si原子、________个C原子。
-SiC立方晶胞中含有_____个Si原子、________个C原子。
参考答案:
【答案】C3N4 两者同属原子晶体(答两者结构相似),C的原子半径小于Si,与Si-N相比,C-N的键长短、键能大 C3N4 sp2、sp3 ![]() π56 4 4
π56 4 4
【解析】
(1)原子晶体中,成键的原子半径越小,则键长越小、键能越大,其硬度就越大。所以Si3N4和C3N4中硬度较高的是C3N4原因是两者同属原子晶体,C的原子半径小于Si,与Si-N相比,C-N的键长短、键能大,故答案为:C3N4;两者同属原子晶体(答两者结构相似),C的原子半径小于Si,与Si-N相比,C-N的键长短、键能大;
(2)由结构可知,每个碳原子与3个氮原子形成2个单键和1个双键,由于氮元素的非金属性强于碳元素,故碳元素显+4价、氮元素显-3价,由此可判断出该化合物的化学式为C3N4。三聚氰胺的环中N原子形成2个σ键,含有1对孤电子对,杂化轨道数目为3,采取sp2杂化,氨基中N原子形成3个σ键,含有1对孤电子对,杂化轨道数目为4,采取sp3杂化,故答案为:C3N4;sp2、sp3;
(3)①氢键发生在非金属强的原子和氢原子之间,在该物质中氢键可表示为![]() ,故答案为:
,故答案为:![]() ;
;
②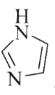 分子中三个C原子采取sp2杂化,每个C原子都有1个p电子,形成3个σ键的N原子采取sp3杂化,含有1对p电子,形成2个σ键的N原子采取sp2杂化,含有1个p电子,五个原子上的6个p电子参与形成离域π键,可表示为π56,故答案为:π56;
分子中三个C原子采取sp2杂化,每个C原子都有1个p电子,形成3个σ键的N原子采取sp3杂化,含有1对p电子,形成2个σ键的N原子采取sp2杂化,含有1个p电子,五个原子上的6个p电子参与形成离域π键,可表示为π56,故答案为:π56;
(4)从该晶胞中原子的坐标参数可知,碳原子位于晶胞的8个顶点和6个面心。每个顶点参与形成8个晶胞,每个面心参与形成2个晶胞,根据均摊法可以计算出一个晶胞中有4个碳原子,而4个硅原子位于晶胞内部,所以SiC立方晶胞中含有4个Si原子、4个C原子,故答案为:4;4。
-
科目: 来源: 题型:
查看答案和解析>>【题目】硫、钒、钴、铂、镧的相关化合物,在药物化学及催化化学等领城应用广泛。回答下列问题:
(1)基态钒原子的电子排布式为__________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是_______.VO43—的几何构型为_________。
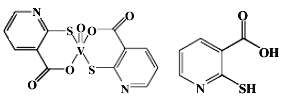
(2)2-巯基烟酸氧钒配合物(分子结构如图)是副作用小的有效调节血糖的新型药物。
①该药物中硫原子的杂化方式是_______.所含第二周期元素第一电离能由大到小的排列顺序为_____________。
②2-巯基烟酸(分子结构如图)水溶性优于2-巯基烟酸氧钒配合物的原因是___________________。
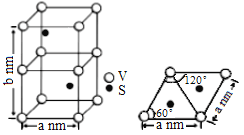
(3)某六方硫钒化合物晶体的晶胞如图所示,该晶胞的化学式为______。为该晶胞俯视图,该晶胞的密度为_____g·cm-3(NA为阿伏加德罗常数的数值.列出计算式即可)。
-
科目: 来源: 题型:
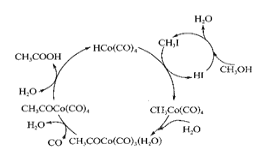
查看答案和解析>>【题目】钴(Co)有多种化合物.在高压条件下.采用钴碘催化循环法制备醋酸过程如图所示。
(1)一种锂钴复合氧化物晶体的结构如图所示,其化学式为___________。

(2)下图表示的总反应的化学方程式为______________________。
(3)基态Co原子的价电子排布图为______________。
(4)1个CH3COCo(CO)4分子中含有
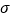 键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。
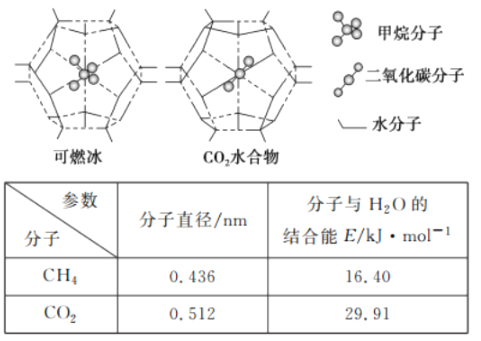
键的数目为______。与CO32—互为等电子体的一种分子的化学式为______________。(5)CH4、CO2是合成CH3OH的基本原料。一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。 CH4与H2O形成的水合物晶体.俗称“可燃冰”。为开采深海海底的“可燃冰’,有科学家提出用以CO2换CH4的设想。已知下图中笼状结构的空腔直径为0.586 nm.结合图表从物质结构及性质的角度分析,该设想的依据是___________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】SO2与漂粉精是常用的漂白剂。某兴趣小组对它们的漂白原理进行探究。过程如下:
I. 探究SO2的漂白性
实验一:将SO2分别通入0.1%品红水溶液和0.1%品红乙醇溶液中,观察到前者褪色而后者不褪色。
实验二:
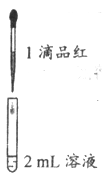
试管中的液体
现象
a. 0.1 mol/L SO2溶液(pH=2)
溶液逐渐变浅,约90s后完全褪色
b. 0.1 mol/L NaHS03溶液(pH=5)
溶液立即变浅,约15s后完全褪色
c. 0.1 mol/L Na2SO3溶液( pH=10)
溶液立即褪色
d. pH=10NaOH溶液
红色溶液不变色
e. pH=2H2SO4溶液
红色溶液不变色
(1)实验d的目的是____________。
(2)由实验一、二可知:该实验条件下,SO2使品红溶液褪色时起主要作用的微粒是____________。
(3)已知S02使品红溶液褪色过程是可逆的。兴趣小组继续试验:向a实验后的无色溶液中滴入Ba(OH)2溶液至pH=10时,生成白色沉淀,溶液变红。
请用离子方程式和必要的文字说明出现上述现象的原因____________。
II. 探究SO2与漂粉精的反应
实验三:
操作
现象

i. 液面上方出现白雾;
ii. 稍后,出现浑浊,溶液变为黄绿色;
iii. 稍后,产生大量白色沉淀,黄绿色褪去
小组同学对上述现象进行探究:
(1)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
a. 用湿润的碘化钾淀粉试纸检验白雾,无变化;
b. 用酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验a目的是____________________。
②由实验a、b不能判断白雾中含有HCl,理由是____________。
(2)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和Cl-发生反应。通过进一步实验确认了这种可能性,其实验方案是____________。
(3)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀x中加入稀HCl,无明显变化。取上层清液,加入BaCl2溶液,产生白色沉淀。则沉淀X中含有的物质是____________。
②用离子方程式解释现象iii中黄绿色褪去的原因________________。
-
科目: 来源: 题型:
查看答案和解析>>【题目】下列关于苯乙烷(
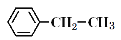 )的叙述,正确的是
)的叙述,正确的是①能使酸性高锰酸钾溶液褪色 ②可以发生加聚反应 ③可溶于水 ④可溶于苯 ⑤能与浓硝酸发生取代反应 ⑥所有原子可能共面
A. ①④⑤ B. ①②⑤⑥ C. ①②④⑤⑥ D. ①②③④⑤⑥
-
科目: 来源: 题型:
查看答案和解析>>【题目】根据下面的信息,下列叙述正确的是( )

A. 2molH2(g)跟1molO2(g)反应生成2molH2O(g)吸收能量为490kJ
B. 1molH2(g)跟0.5molO2(g)反应生成1molH2O(l)吸收能量为245kJ
C. 2molH2O(g)的能量比2molH2(g)与1molO2(g)的能量之和低
D. 化学反应中能量变化的大小与反应物的质量多少无关
-
科目: 来源: 题型:
查看答案和解析>>【题目】铝是最重要的金属之一,铝及其化合物在生活中有广泛的用途。
(1)纳米铝粉可以作高效催化剂、导电膜层、高档金属颜料等。普通铝在空气中能稳定存在,而纳米铝粉在空气中能自燃,从影响反应速率的角度分析其原因是________。
(2)工业上可用铝与软锰矿(主要成分为MnO2)反应来治炼金属锰。
①该反应的化学方程式为_________________。
②MnO2加入酸化后的H2O2溶液中,MnO2溶解,同时产生无色无味的气体。该反应的离子方程式是_____________,该反应中还原剂是___________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]
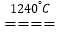 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O将产生的气体通过下图所示装置。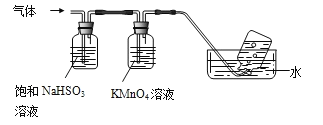
①集气瓶中收集到的气体是_________(填化学式)。
②B中酸性KMnO4溶液褪色(MnO4—还原为Mn2+),发生反应的离子方程式为__________。
(4)Al(OH)3是重要化工原料。电解法制备高品质Al(OH)3的装置如图(中间用离子交换膜隔开),电解总反应方程式为4NaAlO2+10H2O
 4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。
4Al(OH)3↓+4NaOH+O2↑+2H2↑,阳极的电极反应式为____________。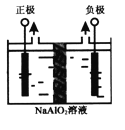
相关试题

